题目内容
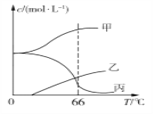
【题目】常温下,将除去表面氧化膜的A1、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示。反应过程中有红棕色气体产生。下列说法错误的是 ( )

A. t1时刻前,A1片的电极反应为:2A1+3H2O - 6e- ═ A12O3+6H+
B. t1时,因A1在浓硝酸中钝化,氧化膜阻碍了A1继续反应
C. t1之后,负极Cu失电子,电流方向发生改变
D. 烧杯中发生的离子反应为:2NO2+2OH- ═ 2NO3-+H2O
【答案】D
【解析】A.t1时刻前,铝片做负极反应,Al发生氧化反应,负极发生2A1-6e-+3H2O===A12O3+6H+,故A正确;B.t1时,随着反应进行铝表面钝化形成氧化膜阻碍反应进行,故B正确;C.随着反应进行铝表面钝化形成氧化膜阻碍反应进行,铜做负极反应,电流方向相反,故C正确;D. NO2溶解于NaOH溶液生成NaNO3和NaNO2,烧杯中发生的离子反应为:2NO2+2OH-=NO3-+NO2-+H2O,故D错误;答案为D。

【题目】下表是周期表中的一部分,根据①﹣⑩在周期表中的位置,用元素符号或化学式回答下列问题:
族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ④ | ⑦ | ⑧ | ⑩ | ||||
3 | ② | ③ | ⑤ | ⑥ | ⑨ |
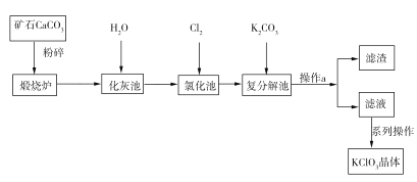
(1)表中元素,化学性质最不活泼的是 , 只有负价而无正价的是 , 还原性最强的单质是 , 可用于制半导体材料的元素是;
(2)最高价氧化物的水化物酸性最强的是 , 呈两性的是 , 最高价氧化物的水化物碱性最强的是 , 电子式为;
(3)在②、③、④、⑤、⑥、⑦、⑧、⑨中,原子半径最大的是;
(4)比较⑥⑦⑨氢化物的稳定性最弱的是;
(5)③元素单质和②元素最高价氧化物对应的水化物相互反应的离子方程式为;
(6)铍(Be)位于元素周期表中第二周期第ⅡA族.相同条件下,单质铍与酸反应比单质锂与酸反应更加(填“剧烈”或“缓慢”),写出铍与盐酸反应的化学方程式 .