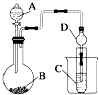
题目内容
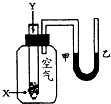
【题目】右图是应用电化学方法检测空气中SO2的原理示意图。下列有关说法不正确的是

A. 该装置工作时能将化学能转变为电能,并有H2SO4生成
B. 电极b表面O2发生还原反应,电极附近溶液的pH升高
C. 电极a表面的电极反应式为:SO2+2H2O-2e-===SO![]() +4H+
+4H+
D. 气体样品应从电极a区域通入,样品中的SO2在电极a表面得到电子
【答案】D
【解析】试题分析:由图中信息可知,该装置是原电池,电池总反应为2SO2+O2+2H2O=2H2SO4,工作时能将化学能转变为电能,并有H2SO4生成。空气通入左室,空气中的二氧化硫被氧化为硫酸,所以电极a是负极,电极反应式为SO2+2H2O-2e-===SO![]() +4H+;电极b是正极,电极反应式为O2+4e-+4H+=2H2O,氧气发生还原反应,电极b附近溶液的pH升高。综上所述,A、B、C正确,D不正确,本题选D。
+4H+;电极b是正极,电极反应式为O2+4e-+4H+=2H2O,氧气发生还原反应,电极b附近溶液的pH升高。综上所述,A、B、C正确,D不正确,本题选D。

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
【题目】下表是周期表中的一部分,根据①﹣⑩在周期表中的位置,用元素符号或化学式回答下列问题:
族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ④ | ⑦ | ⑧ | ⑩ | ||||
3 | ② | ③ | ⑤ | ⑥ | ⑨ |
(1)表中元素,化学性质最不活泼的是 , 只有负价而无正价的是 , 还原性最强的单质是 , 可用于制半导体材料的元素是;
(2)最高价氧化物的水化物酸性最强的是 , 呈两性的是 , 最高价氧化物的水化物碱性最强的是 , 电子式为;
(3)在②、③、④、⑤、⑥、⑦、⑧、⑨中,原子半径最大的是;
(4)比较⑥⑦⑨氢化物的稳定性最弱的是;
(5)③元素单质和②元素最高价氧化物对应的水化物相互反应的离子方程式为;
(6)铍(Be)位于元素周期表中第二周期第ⅡA族.相同条件下,单质铍与酸反应比单质锂与酸反应更加(填“剧烈”或“缓慢”),写出铍与盐酸反应的化学方程式 .