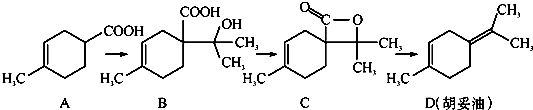
题目内容
【题目】在共价化合物中,元素化合价有正负的主要原因是( )
A.电子有得失
B.共用电子对有偏移
C.电子既有得失又有电子对偏移
D.有金属元素的存在
【答案】B
【解析】
共价键的形成不存在电子的得失,只有电子的共用,共用电子对的偏移使元素的化合价有正负之别。离子键的形成存在电子的得失。故选B。

 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案【题目】1000 mL某待测溶液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种如下表,现进行如下实验操作(每次实验所加试剂均过量):
阳离子 | K+、NH |
阴离子 | Cl-、Br-、CO |
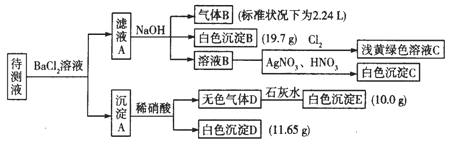
(1)写出生成白色沉淀B的离子方程式:_________。
(2)待测液中肯定不存在的阳离子是_______。
(3)若无色气体D是单一气体:判断原溶液中K+是否存在____(填“是”或“否”),若存在,求其物质的量浓度的最小值,若不存在,请说明理由:__________。
【题目】下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
A | B | C | D | |
强电解质 | Fe | CaCO3 | NaCl | HNO3 |
弱电解质 | CH3COOH | H3PO4 | NH3 | Fe(OH)3 |
非电解质 | 蔗糖 | 酒精 | BaSO4 | Al2O3 |
A. A B. B C. C D. D
【题目】将等物质的量X和Y加入密闭容器,在一定条件下发生反应:X(g)+Y(g)Z (s)+2W(g),平衡时W的体积分数(%)随温度和压强的变化如表所示.
1.0 MPa | 2.0 MPa | 3.0 MPa | |
800℃ | a | b | 83% |
900℃ | c | 75% | d |
1000℃ | 54% | e | f |
①a>c>f ②900℃、2.0MPa时,X的转化率为75% ③该反应的△H<0 ④平衡常数K(1000℃)>K(800℃)上述①~④中正确的有( )
A.4个
B.3个
C.2个
D.1个
【题目】利用如图装置制取ClO2 , 并以ClO2为原料制备亚氯酸钠(NaClO2是一种高效氧化剂、漂白剂).已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO23H2O,高于38℃时析出晶体是NaClO2 , 高于60℃时NaClO2分解成NaClO3和NaCl. 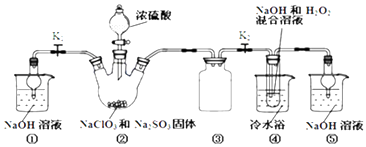
完成下列填空:
(1)装置②中产生ClO2的化学方程式为;装置④中发生反应的离子方程式为 .
(2)装置③的作用是;装置①和⑤在本实验中的作用 .
(3)装置④反应后的溶液中还含有少量NaOH杂质,从该溶液获得无水NaClO2晶体的操作步骤为:①减压,55℃左右蒸发结晶;②趁热过滤;③用50℃左右的温水洗涤;④低于60℃干燥,得到成品.步骤③中用50℃左右的温水洗涤的原因是 .
(4)亚氯酸钠纯度测定:①准确称取所得亚氯酸钠样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应.将所得混合液配成250mL待测溶液.②取25.00mL待测液,用2.0 molL﹣1Na2S2O3标准液滴定(I2+2S2O32﹣=2I﹣+S4O62﹣),以淀粉溶液做指示剂,达到滴定终点时的现象为 . 重复滴定3次,测得数据如表所示,则该样品中NaClO2的质量分数为 .
实验序号 | 滴定前读数/mL | 滴定后读数/mL |
1 | 0.00 | 19.96 |
2 | 3.26 | 23.30 |
3 | 1.10 | 23.40 |
(5)实验过程中若NaClO2变质可分解为NaClO3和NaCl.取等质量NaClO2 , 其中一份加热高于60℃使之变质,另一份严格保存,均配成溶液,并分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量(填“相同”“不相同”或“无法判断”).