��Ŀ����
����Ŀ����(N2H4)��һ����Ҫ��Һ̬���ȼ�ϣ�����ǿ��ԭ������ҵ����������[CO(NH2)2]��NaClO��NaOH��Һ�з�����Ӧ����ˮ����(N2H4��H2O)��Na2CO3�����ʡ�
��1���������ʵ�Ħ���������µ�Ħ��������ͬ����______(����ĸ)��
A.���� B.���� C.�軯�� D.����
��2����������ˮ���µķ�Ӧ��������_____(������������������ԭ����)��������Ӧ�Ļ�ѧ����ʽΪ_________________��
��3�����������۷ɴ��ij������������ȼ�����Զ��������������������߷�Ӧ�����ɵ�����ˮ���÷�Ӧ��ÿ����6.72L(��״��)N2��ת�Ƶ��ӵ����ʵ���Ϊ________��
��4����ȼ���ײ���NO������Ư����Һ�ѳ�NO��Ϊ���NO���ѳ�����������������ͬʱ����Ư����Һ�зֱ�������ֲ�ͬ���Ӽ���������NO�ѳ��ʵ�Ӱ����ͼ��ʾ����ͼ��֪��KMnO4��H2O2��NaClO2��������������ǿ��˳����_______________��

���𰸡� AC ��ԭ�� CO(NH2)2+NaClO+2NaOH=N2H4��H2O+Na2CO3+NaCl 0.8mol NaClO2<H2O2<KMnO4
����������1���µ�Ħ��������32g/mol��ѡ�����������ʵ�Ħ�������ֱ���32g/mol��34g/mol��32g/mol��38g/mol����ѡAC����2�������е�Ԫ�ػ��ϼ۴ӣ�3�����ߵ���2�ۣ�������������ˮ���µķ�Ӧ����������ԭ��������������������������ԭ���غ��֪����̼���ƺ��Ȼ������ɣ���������Ӧ�Ļ�ѧ����ʽΪCO(NH2)2+NaClO+2NaOH��N2H4��H2O+Na2CO3+NaCl����3����Ӧ�ķ���ʽΪ2N2H4+2NO2=3N2+4H2O��ÿ����3mol����ת��8mol���ӣ���˷�Ӧ��ÿ����6.72L(��״��)N2��0.3mol����ʱ��ת�Ƶ��ӵ����ʵ���Ϊ0.8mol����4����ͼ��֪������ص��ѳ�����ߣ������˫��ˮ������KMnO4��H2O2��NaClO2��������������ǿ��˳����NaClO2<H2O2<KMnO4��

����Ŀ��������ͼװ����ȡClO2 �� ����ClO2Ϊԭ���Ʊ��������ƣ�NaClO2��һ�ָ�Ч��������Ư��������֪��NaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO23H2O������38��ʱ����������NaClO2 �� ����60��ʱNaClO2�ֽ��NaClO3��NaCl�� 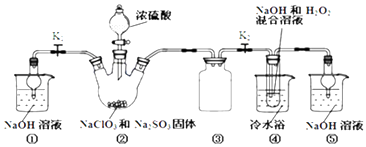
���������գ�
��1��װ�â��в���ClO2�Ļ�ѧ����ʽΪ��װ�â��з�����Ӧ�����ӷ���ʽΪ ��
��2��װ�â۵���������װ�âٺ͢��ڱ�ʵ���е����� ��
��3��װ�âܷ�Ӧ�����Һ�л���������NaOH���ʣ��Ӹ���Һ�����ˮNaClO2����IJ�������Ϊ���ټ�ѹ��55�����������ᾧ���ڳ��ȹ��ˣ�����50�����ҵ���ˮϴ�ӣ��ܵ���60�����õ���Ʒ�����������50�����ҵ���ˮϴ�ӵ�ԭ���� ��
��4���������ƴ��Ȳⶨ����ȷ��ȡ��������������Ʒ10.0g���ձ��У�������������ˮ�����ĵ⻯�ؾ��壬�ٵ���������ϡ���ᣬ��ַ�Ӧ�������û��Һ���250mL������Һ����ȡ25.00mL����Һ����2.0 molL��1Na2S2O3��Һ�ζ���I2+2S2O32��=2I��+S4O62�������Ե�����Һ��ָʾ�����ﵽ�ζ��յ�ʱ������Ϊ �� �ظ��ζ�3�Σ�������������ʾ�������Ʒ��NaClO2����������Ϊ ��
ʵ����� | �ζ�ǰ����/mL | �ζ������/mL |
1 | 0.00 | 19.96 |
2 | 3.26 | 23.30 |
3 | 1.10 | 23.40 |
��5��ʵ���������NaClO2���ʿɷֽ�ΪNaClO3��NaCl��ȡ������NaClO2 �� ����һ�ݼ��ȸ���60��ʹ֮���ʣ���һ���ϸ棬�������Һ�����ֱ�������FeSO4��Һ��Ӧʱ������Fe2+�����ʵ��������ͬ��������ͬ�������жϡ�����
