题目内容
8. 甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1①已知:2CO(g)+O2(g)═2CO2(g)△H2=-566kJ•mol-1;2H2(g)+O2(g)═2H2O(g)△H3=-484kJ•mol-1.则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1;
②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.请回答:
A)在上述三种温度中,曲线Z对应的温度是270℃.
B)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g)的平衡常数K=4L2•mol-2.(写明单位)
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
分析 ①根据盖斯定律和题中热化学方程式写出甲醇完全燃烧生成二氧化碳的热化学方程式;
②A、合成甲醇的反应是放热反应,温度升高,转化率降低;
B、根据平衡常数表达式和一氧化碳的转化率求算;
③根据5min和10min时各物质浓度的变化来确定改变条件
解答 解:①根据反应①CO(g)+2H2(g)?CH3OH(g);△H1=-116kJ•mol-1,
②2CO(g)+O2(g)═2CO2(g)△H2=-566kJ•mol-1;,
③2H2(g)+O2(g)═2H2O(g)△H3=-484kJ•mol-1,
根据盖斯定律:①-$\frac{②}{2}$-③得:
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1,
故答案是:CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1;
②A、根据反应CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1,是放热反应,温度越高,转化率越低,所以曲线Z对应的温度是270℃,
故答案是:270℃;
B、该反应的平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)•c({H}_{2})^{2}}$,
a点时,CO转化率50%,反应消耗了2mol×50%=1molCO,消耗氢气2mol
剩余1molCO,n(H2)=3mol-2mol=1mol,生成1mol甲醇,
a点各组分的浓度是:c(CH3OH)=$\frac{1mol}{2L}$=0.5mol/L,c(CO)=$\frac{1mol}{2L}$=0.5mol/L,c(H2)=$\frac{1mol}{2L}$=0.5mol/L,
带人表达式得:K=$\frac{0.5mol/L}{0.5mol/L×(0.5mol/L)^{2}}$=4L2•mol-2,
故答案是:4L2•mol-2;
③反应达到平衡时,根据反应方程式知各物理量之间的关系式知,c(CO)=0.1mol/L-0.04mol/L=0.06mol/L,
C(H2)=0.2mol/L-0.08mol/L=0.12mol/L,10min时,c(CO)减小,c(H2)增大,c(CH3OH)增大,
则平衡向正反应方向移动,但氢气浓度增大,所以改变的物理量是增大了氢气的浓度,氢气浓度增大了0.2mol/L-0.12mol/L+0.02mol/L=0.1mol/L,
故答案为:增大H2的浓度;增大了0.1 mol•L-1.
点评 本题考查了影响反应速率的因素及反应平衡常数的计算、热化学方程式的书写等知识,注意盖斯定律的应用,本题难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 金属焊接时可用NH4Cl溶液作除锈剂 | |
| B. | 配制FeSO4溶液时,加入一定量Fe粉 | |
| C. | 长期施用铵态氮肥会使土壤酸化 | |
| D. | 向FeCl3溶液中加入CaCO3粉末后有气泡产生 |
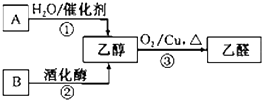 气态烃A中碳元素与氢元素的质量比为6:1.淀粉在一定条件下水解可生成B.B在人体组织中缓慢氧化,放出热量,提供生命活动所需能量.有关物质的转化关系如图:
气态烃A中碳元素与氢元素的质量比为6:1.淀粉在一定条件下水解可生成B.B在人体组织中缓慢氧化,放出热量,提供生命活动所需能量.有关物质的转化关系如图: 某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.
某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.