题目内容
16.设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )①常温常压下,19g甲烷(CHD3)所含的中子数为9NA
②64g的铜发生氧化还原反应,一定失去2NA个电子
?常温常压下,22.4L N2气体的分子数大于NA
④常温常压下,100mL 0.5mol/L的乙酸溶液中,乙酸的分子数目小于0.05NA.
| A. | ①② | B. | ①④ | C. | ③④ | D. | ①③ |
分析 ①甲烷(CHD3)的摩尔质量为19g/mol,而1mol甲烷(CHD3)中含9mol中子;
②求出铜的物质的量,然后根据反应后铜可能变为+1价或+2价;
③常温常压下,气体摩尔体积大于22.4L/mol;
④乙酸为弱电解质,在溶液中部分电离.
解答 解:①甲烷(CHD3)的摩尔质量为19g/mol,故19g甲烷的物质的量为1mol,而1mol甲烷(CHD3)中含9mol中子,即9NA个,故①正确;
②64g铜的物质的量为1mol,而反应后铜可能变为+1价或+2价,故1mol铜可能失去NA个电子或2NA个电子,故②错误;
③常温常压下,气体摩尔体积大于22.4L/mol,故22.4L氮气的物质的量小于1mol,即分子数小于NA个,故③错误;
④乙酸为弱电解质,在溶液中部分电离,故溶液中的分子个数小于0.05NA个,故④正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
6.某同学欲配制0.55mo1•L-1的NaOH溶液200mL(存在200mL容量瓶).称量操作如下:
①先用托盘天平称量烧杯的质量.称量前先调节天平零点.用“↓”表示在天平右盘上放置砝码,用“↑”表示从天平右盘上取下砝码.取用砝码情况和游码读数如表:

烧杯的质量为33.2g.
②称量烧杯和NaOH固体的质量.再在天平右盘上放置5g砝码,将游码的位置移到2.6g的位置,往烧杯中逐渐加入NaOH固体,直到天平达到平衡.
①先用托盘天平称量烧杯的质量.称量前先调节天平零点.用“↓”表示在天平右盘上放置砝码,用“↑”表示从天平右盘上取下砝码.取用砝码情况和游码读数如表:
| 砝码质量 | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 | 先↓后↑ | ↓ | 先↓后↑ | ↓ | 先↓后↑ |

烧杯的质量为33.2g.
②称量烧杯和NaOH固体的质量.再在天平右盘上放置5g砝码,将游码的位置移到2.6g的位置,往烧杯中逐渐加入NaOH固体,直到天平达到平衡.
7.下列属于酸性氧化物的是( )
| A. | CO2 | B. | CaO | C. | K2SO4 | D. | NaOH |
1. 某实验小组配制0.10mol/L NaOH溶液并进行有关性质实验,回答下列问题.
某实验小组配制0.10mol/L NaOH溶液并进行有关性质实验,回答下列问题.
(1)若实验中大约要使用475mL NaOH溶液,至少需要称量NaOH固体2.0g.
(2)从图中选择称量NaOH固体所需要的仪器是(填字母)abe.
(3)下列情况会使所配溶液浓度偏低的是(填序号)①③⑤⑥
①称量时,左盘高,右盘低
②固体溶解后未冷却到室温就直接转移到容量瓶中
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度实验室欲配制
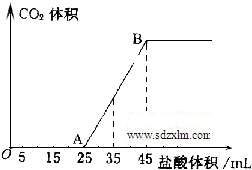
(4)向VmL上述浓度的NaOH溶液中,通入一定量的CO2后,然后向该溶液中逐滴加入1mol.L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如图所示:
①当加入35.0mL盐酸溶液时,产生标准状况下二氧化碳的体积为224mL;
②计算所取氢氧化钠溶液的体积V=450mL.
(5)取上述氢氧化钠溶液200mL,加入适量铝粉使之恰好完全反应,该反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,逐渐向反应后的溶液中至少加入1.0mol.L-1的盐酸80 mL才能使生成的沉淀完全溶解.
 某实验小组配制0.10mol/L NaOH溶液并进行有关性质实验,回答下列问题.
某实验小组配制0.10mol/L NaOH溶液并进行有关性质实验,回答下列问题.(1)若实验中大约要使用475mL NaOH溶液,至少需要称量NaOH固体2.0g.
(2)从图中选择称量NaOH固体所需要的仪器是(填字母)abe.
| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
①称量时,左盘高,右盘低
②固体溶解后未冷却到室温就直接转移到容量瓶中
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度实验室欲配制
(4)向VmL上述浓度的NaOH溶液中,通入一定量的CO2后,然后向该溶液中逐滴加入1mol.L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如图所示:
①当加入35.0mL盐酸溶液时,产生标准状况下二氧化碳的体积为224mL;
②计算所取氢氧化钠溶液的体积V=450mL.
(5)取上述氢氧化钠溶液200mL,加入适量铝粉使之恰好完全反应,该反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,逐渐向反应后的溶液中至少加入1.0mol.L-1的盐酸80 mL才能使生成的沉淀完全溶解.
8. 甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1
①已知:2CO(g)+O2(g)═2CO2(g)△H2=-566kJ•mol-1;2H2(g)+O2(g)═2H2O(g)△H3=-484kJ•mol-1.则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1;
②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.请回答:
A)在上述三种温度中,曲线Z对应的温度是270℃.
B)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g)的平衡常数K=4L2•mol-2.(写明单位)
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
若5min~10min只改变了某一条件,所改变的条件是增大H2的浓度;且该条件所改变的量是增大了0.1mol•L-1.
 甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1①已知:2CO(g)+O2(g)═2CO2(g)△H2=-566kJ•mol-1;2H2(g)+O2(g)═2H2O(g)△H3=-484kJ•mol-1.则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1;
②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.请回答:
A)在上述三种温度中,曲线Z对应的温度是270℃.
B)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g)的平衡常数K=4L2•mol-2.(写明单位)
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
5.下列除杂方法不合理的是( )
| A. | 通过饱和食盐水除去Cl2中的HCl | |
| B. | 通过NaOH溶液除去CO2中的HCl | |
| C. | 通过加热法除去Na2CO3固体中的NaHCO3 | |
| D. | 通过NaOH溶液除去CO中混有的CO2 |
 )、乙醛(CH3CHO)、乙酸(CH3COOH)、乙醇(CH3CH2OH).
)、乙醛(CH3CHO)、乙酸(CH3COOH)、乙醇(CH3CH2OH).