题目内容
【题目】将废弃锂离子电池再生处理,制Co3O4的工艺流程如图所示:
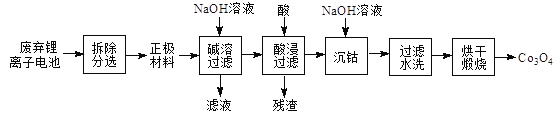
已知:锂离子电池正极材料是由活性材料(LiCoO2)、导电剂(炭黑)按一定比例粘附在铝箔上。Ksp[Co(OH)2]=1.6×10-15,本流程中完全沉淀时溶液中c(Co2+)≤1×10-6 mol/L。Co3+有强氧化性,易转化为+2价形态存在于水溶液中。
(1)锂离子电池工作时的总反应为6C+LiCoO2![]() Li1-xCoO2+LixC6,充电时阴极的电极反应式为6C+xLi++xe-=LixC6,写出放电时正极的电极反应式_____________________。
Li1-xCoO2+LixC6,充电时阴极的电极反应式为6C+xLi++xe-=LixC6,写出放电时正极的电极反应式_____________________。
(2)常用H2SO4酸浸而不用盐酸,因为盐酸酸浸LiCoO2时会生成氯气,该反应的化学方程式为_____________。
(3)当Co(OH)2完全沉淀时,浸出液中应加NaOH溶液至c(OH-)≥__________________。
(4)检验Co(OH)2沉淀洗净的方法是________________________。
(5)在空气中加热Co(OH)2至290℃时已完全脱水,到1000℃时剩余固体的质量为Co(OH)2质量的80.65%。则剩余固体的成分为____________________(填化学式)。(Co:59 Co(OH)2式量:93 )
【答案】Li1-xCoO2 +xLi++xe- =LiCoO2 2LiCoO2+8HCl=2CoCl2+Cl2↑+2LiCl+4H2O 4×10-5 mol/L 取最后一次洗涤滤液于试管中,滴加盐酸酸化的氯化钡溶液,无白色沉淀产生 CoO
【解析】
(1)放电时正极发生还原反应,根据总反应方程式书写;
(2)盐酸与LiCoO2发生氧化还原反应产生Cl2、CoCl2、LiCl和水,根据电子转移数目相等可得反应方程式;
(3)根据溶度积常数的含义,结合Ksp[Co(OH)2]=1.6×10-15及溶液中c(Co2+)≤1×10-6 mol/L计算c(OH-);
(4) Co(OH)2沉淀是从含H2SO4的溶液中过滤出来的,若洗涤溶液中无SO42-,就证明沉淀洗涤干净;
(5)在灼烧过程中Co元素的质量不变,根据Co的质量分数,计算Co、O原子个数比,可得化学式。
(1)放电时正极发生还原反应,根据放电时的反应方程式可得正极的电极反应式为:Li1-xCoO2 +xLi++xe- =LiCoO2;
(2)盐酸与LiCoO2发生氧化还原反应产生Cl2、CoCl2、LiCl和水,根据电子转移数目相等可得反应方程式2LiCoO2+8HCl=2CoCl2+Cl2↑+2LiCl+4H2O;
(3) Ksp[Co(OH)2]= c(Co2+)·c2(OH-)=1.6×10-15;由于c(Co2+)≤1×10-6 mol/L,所以c(OH-)≥![]() =4.4×10-5mol/L;
=4.4×10-5mol/L;
(4)检验Co(OH)2沉淀洗净的方法是取最后一次洗涤滤液于试管中,滴加盐酸酸化的氯化钡溶液,无白色沉淀产生,证明洗涤溶液中无SO42-,则该沉淀洗涤干净了;
(5)根据质量守恒定律,在变化过程中,Co的质量没有变,假设原始固体质量为100g,则n(Co)=![]() mol;m(Co)=
mol;m(Co)=![]() ×59g,m(O)=(100g×80.65%)-
×59g,m(O)=(100g×80.65%)-![]() ×59g,则n(Co):n(O)=
×59g,则n(Co):n(O)=![]() mol:[
mol:[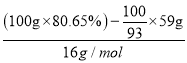 ]=1:1,所以该物质的化学式为CoO。
]=1:1,所以该物质的化学式为CoO。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】I、如图所示,高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是______________。
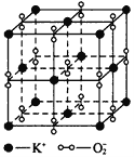
A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O![]()
B.晶体中每个K+周围有8个O![]() ,每个O
,每个O![]() 周围有8个K+
周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中,0价氧与-2价氧的数目比为3∶1
II、有A、B、C三种晶体,分别由C、H、Na、Cl四种元素中的一种或几种形成,对这3种晶体进行实验,结果如表所示:
项目 | 熔点/℃ | 硬度 | 水溶性 | 导电性 | 水溶液与Ag+反应 |
A | 811 | 较大 | 易溶 | 水溶液(或熔融)导电 | 白色沉淀 |
B | 3500 | 很大 | 不溶 | 不导电 | 不反应 |
C | -114.2 | 很小 | 易溶 | 液态不导电 | 白色沉淀 |
(1)晶体A的化学式为____________________。
(2)晶体B的晶体类型为____________________。
(3)晶体C中粒子间的作用力为____________________。
III、砷化镓是优良的半导体材料,可用于制作微型激光器或太阳能电池等。
(1)砷化镓的晶胞结构如下图所示,则砷化镓的化学式为____。

(2)基态As原子的核外电子排布式为_________。
(3)第一电离能:Ga____As(填“>”或“<”)。
(4)GaF3的熔点高于1 000 ℃,GaCl3的熔点为77.9 ℃,其原因是_________。
【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ⑤ | |||||
3 | ③ | ⑥ | |||||
4 | ④ | ⑦ | |||||
(1)表中________(填元素符号)的非金属性最强;________(填元素符号)的金属性最强,写出该元素的单质与水反应的离子方程式:___________________________________________________。
(2)表中元素③的原子结构示意图是____________。
(3)表中元素⑥、⑦的氢化物的稳定性顺序为
(4)表中元素最高价氧化物对应水化物酸性最强的是________(填化学式)。