题目内容
【题目】铜及其化合物在工业生产中应用广泛。
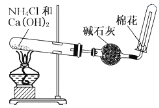
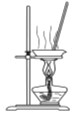
Ⅰ.某同学设计如下实验装置测定铜的相对原子质量(夹持和加热仪器已略去),并检验氯气的氧化性。
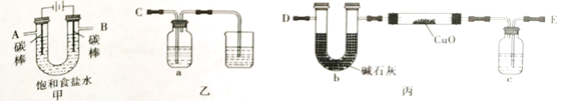
(1)该实验装置的连接顺序为:A连接________,B连接________(填字母)。
(2)乙装置a瓶中的溶液可以是_______
A.NaOH溶液 B.Na2S溶液 C.酸性KMnO4溶液 D.含少量KSCN的FeCl2溶液
(3)对丙装置进行加热前需要________ 。
(4)准确称量 m g CuO进行实验,当CuO完全反应后测出b中增重n g。则Cu的相对原子质量为________ (只要求列出算式)。该实验方案的装置有不合理之处,若不加以改正会导致测定结果________(填“偏大”、”偏小“或”不变“)。
Ⅱ.研究发现Cu与稀盐酸不反应,但在持续通入空气的条件下可反应生成CuCl2。
(5)已知Fe3+对该反应有催化作用,其催化原理如图所示:
![]()
则图中的M‘为________(填化学符号)
(6)向CuCl2溶液中通入H2S气体,可产生CuS沉淀,反应离子方程式为:Cu2++H2S=CuS(s)+2H+ , 则该反应的平衡常数K=________(保留一位小数)。已知:CuS溶度积KSP=1.0×10-36 , H2S电离常数Ka1=1.3×10-7 , Ka2=7.0×10-15。
【答案】E C B、D 使装置内充满H2或利用H2排尽装置里的空气 (18m-16n)/n 偏小 Fe2+(或FeCl2) 9.1×1014
【解析】
电解饱和食盐水生成氢气、氯气和氢氧化钠;依据装置图分析可知,电解饱和食盐水阳极B是氯离子失电子发生氧化反应生成氯气,阴极A是氢离子得到电子发生还原反应,生成氢气,电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性,装置丙中的E接电解装置中的A;装置乙是验证氯气氧化性的装置,D接电解池的B电极;检验氯气的氧化性可以利用还原性的物质发生反应,且有明显的现象,可以把氯气通入具有还原性的Na2S溶液和含少量KSCN的FeCl2溶液发生氧化还原反应;生成S单质,溶液变浑浊和溶液由绿色变为血红色; 使装置内充满H2或利用H2排尽装置里的空气;方案是测定水的质量增加计算,装置D会吸收空气中的水蒸气和二氧化碳使测定结果偏低;Fe3+对该反应有催化作用,结合图可知,Cu元素的化合价升高,则M中Fe元素的化合价降低,可知M的化学式为Fe2+;
(1)A端碳棒与电源的负极相连,为阴极,其电极反应式为2H2O+2e-=H2↑+2OH-;B端与电源的正极相连,为阳极,其电极反应式为:2Cl--2e-=Cl2↑;因此A应连接E,B应连接E;
(2)乙装置a瓶中试剂是用于检验氯气的氧化性,因此a瓶中试剂应具有还原性;
A、NaOH不具有还原性,A不符合题意;
B、Na2S中硫元素为-2价,具有还原性,Cl2能将S2-氧化成S单质,产生淡黄色沉淀,B符合题意;
C、酸性KMnO4溶液具有氧化性,不具有还原性,C不符合题意;
D、FeCl2溶液中Fe2+具有还原性,Cl2能将Fe2+氧化成Fe3+,Fe3+遇SCN-显红色,D符合题意;
故答案为:BD
(3)H2是可燃性气体,加热前应排除装置内的空气,因此对丙装置进行加热前需要先利用H2排除装置内的空气;
(4)b装置中的碱石灰主要用于吸收反应生成的H2O,因此b装置增加的质量为反应生成H2O的质量,令Cu的相对原子质量为x,则
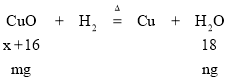
则可得等式![]() , 解得
, 解得![]() ;
;
由于空气中的CO2和H2O也能进入b装置中,被碱石灰吸收,使得n偏大,由![]() 可知,x值偏小,即测定结果偏小;
可知,x值偏小,即测定结果偏小;
(5)催化过程中,Cu转化为Cu2+,发生氧化反应,则Fe3+应发生还原反应,转化为Fe2+;
(6)该反应的平衡常数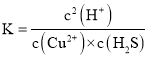 ,CuS的溶度积Ksp=c(Cu2+)×c(S2-) ,H2S的电离常数
,CuS的溶度积Ksp=c(Cu2+)×c(S2-) ,H2S的电离常数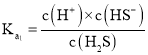 、
、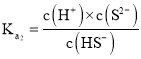 ,因此反应的平衡常数
,因此反应的平衡常数![]() 。
。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。查阅资料:
平衡Ⅰ:Cu(OH)2+4NH3![]() [Cu(NH3)4]2+2OH-
[Cu(NH3)4]2+2OH-
平衡Ⅱ:Cu(OH)2+2OH-![]() [Cu(OH-)4]2-
[Cu(OH-)4]2-
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/mg·L-1 | 72 | ≤0.5 |
Nh4+/mg·L-1 | 2632 | ≤15 |
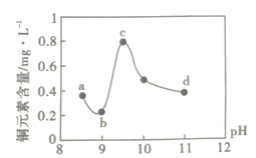
下列说法错误的是( )
A.a~b段发生的反应为:Cu2++2OH-=Cu(OH)2↓
B.b~c段:随pH升高,Cu(OH)2的量增加,导致平衡Ⅰ正向移动,铜元素含量上升
C.c~d段:随pH升高,c(OH-)增加,平衡Ⅰ逆向移动,铜元素含量下降
D.d点以后,随c(OH-)增加,铜元素含量可能上升
【题目】下列实验“操作和现象”与“实验目的、结论”的对应关系中正确的是( )
操作和现象 | 实验目的或结论 | |
A | 将H2S气体通入CuSO4溶液中,产生黑色沉淀 | H2S的酸性比H2SO4的强 |
B | 固体溶解于水后的溶液中加入澄清的石灰水 | 探究家庭“食用碱”的成分是 碳酸钠还是碳酸氢钠 |
C | 某溶液先加稀硝酸,再加BaCl2溶液,产生白色沉淀 | 能证明该溶液中一定含有Ag+ |
D | 向MgCl2溶液(含FeCl3)中加入足量MgCO3粉末 | 除去MgCl2溶液中少量FeCl3 |
A. AB. BC. CD. D