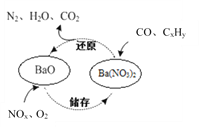
题目内容
【题目】已知0.1mol/L的醋酸溶液中存在CH3COOHCH3COO﹣+H+ . 要使溶液中 ![]() 值增大,可以采取的措施是( )
值增大,可以采取的措施是( )
A.加少量烧碱固体
B.升高温度
C.加少量冰醋酸
D.加少量醋酸钠固体
【答案】B
【解析】解:A.加入烧碱溶液,反应生成CH3COO﹣,c(H+)减小,c(OH﹣)增大,Ka= ![]() 不变,c(CH3COO﹣)增大,则
不变,c(CH3COO﹣)增大,则 ![]() 减小,故A错误;
减小,故A错误;
B.弱电解质的电离为吸热过程,加热促进电离,c(H+)增大,c(CH3COOH)减小,则 ![]() 增大,故B正确;
增大,故B正确;
C.加少量冰醋酸,醋酸浓度增大,弱电解质的浓度越大,电离程度越小,则 ![]() 减小,故C错误;
减小,故C错误;
D.加少量醋酸钠固体,电离平衡逆向移动,则氢离子浓度减小,醋酸浓度增大,则 ![]() 减小,故D错误.
减小,故D错误.
故选B.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.

 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L 恒容密闭容器中,发生反应:X(g)+Y(g)═2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表:下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率ν(Z)=2.0×10﹣5 mol/(Lmin)
B.4min时,ν(逆)>ν(正)
C.该温度下,此反应的平衡常数K=1.44
D.7min时,反应还未达到平衡状态
【题目】工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)CH3OH(g)的平衡常数.下列说法正确的是 ( )
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10﹣2 | 2.4×10﹣4 | 1×10﹣5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2 , 达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高
【题目】实验室可用草酸(H2C2O4)在浓硫酸的作用下分解得一氧化碳,某研究小组利用如图所示装置探究温度对CO还原Fe2O3的影响(固定装置略):

(1)草酸(H2C2O4)在浓硫酸的作用下分解制取一氧化碳的化学方程式为_____________________。
(2)装置C的作用是_______________,加热D装置之前需进行的操作是___________________。
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀硫酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
①甲组步骤1中反应的化学方程式为_________________________。
②甲组步骤3中,溶液变红的离子方程式为______________________。
③乙组得到的黑色粉末是_____________(填化学式)。
④乙组步骤4中,溶液褪色可能的原因及其验证方法为_______________________。
(4)该装置的改进措施除了在E装置后加尾气处理装置外还需_______________________。