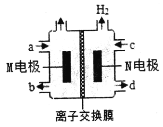
��Ŀ����
����Ŀ���������ͭ( II )��ؾ���{K2[Cu(C2O4)2]��2H2O}��������ˮ����������ˮ�����ھƾ�������ʱ��Ϊ�ȶ�������ʱ�ֽ⡣
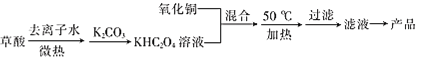
I.������ͭ�Ͳ���Ϊԭ���Ʊ��������ͭ(II)��ؾ�����������£�
��֪��H2C2O4![]() CO��+CO2��+H2O
CO��+CO2��+H2O
�ش��������⣺
(1)��H2C2O4�������ȥ����ˮ�У��ȣ��ܽ�������¶Ȳ���̫�ߣ�ԭ����________��
(2)��CuO��KHC2O4�Ļ��Һ��50��C�³�ַ�Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ__________��
(3)50 ��Cʱ����������Ӧ��ֺ�IJ�����_______________(����ĸ)��
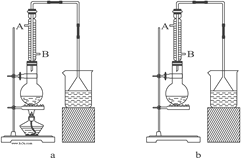
A.���ڱ�ˮ����ȴ����� B.��Ȼ��ȴ�����
C.���ȹ��� D.����Ũ������ȴ�����
II.��CuSO4��5H2O�����K2C2O4����Ϊԭ���Ʊ��������ͭ( II )��ؾ��塣
ʵ�鲽�裺��CuSO4��5H2O�����K2C2O4����ֱ���ȥ����ˮ�ܽ��K2C2O4��Һ��μ�������ͭ��Һ�У��о�����������ڱ�ˮ����ȴ�����ˣ��þƾ�ϴ�ӣ���ˮԡ���ϳ��ɡ���ʱ���Ͻ��裬�õ���Ʒ��
(4)�þƾ���������ˮϴ�ӵ�Ŀ����____________��
II.��Ʒ���ȵIJⶨ��ȷ��ȡ�Ƶõľ�������ag����NH3��H2O�У�����ˮ������250mL��ȡ������Һ25.00mL���ټ���10 mL��ϡ���ᣬ��b mol��L-1 ��KMnO4��Һ�ζ�������KMnO4��ҺV mL��
(5)�ζ�ʱ�����еζ���ʽ�У����������______(����ĸ)������Ϊ________�� (�гֲ�����ȥ)
A. 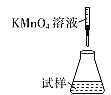 B.
B. 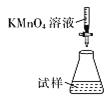 C.
C. 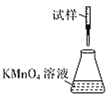
(6)���ڽӽ��ζ��յ�ʱ������������ˮ����ƿ�ڱڳ�ϴһ�£��ټ����ζ����յ㣬ʵ������_____(����ƫ����ƫС��������Ӱ����)��
(7)�ò�Ʒ�Ĵ���Ϊ___________(д������ʽ)��
���𰸡��¶ȹ��߲����ֽ� 2KHC2O4+CuO![]() K2[Cu��C2O4��2]+H2O C �ƾ��ӷ������ڸ���������ͭ( II )��ؾ��� B �ζ�ʱ����ҺӦʢ���ڵζ����У�����ҺӦʢ������ƿ�У��������Ϊǿ��������ҺӦʹ����ʽ�ζ��� ��Ӱ��
K2[Cu��C2O4��2]+H2O C �ƾ��ӷ������ڸ���������ͭ( II )��ؾ��� B �ζ�ʱ����ҺӦʢ���ڵζ����У�����ҺӦʢ������ƿ�У��������Ϊǿ��������ҺӦʹ����ʽ�ζ��� ��Ӱ�� ![]()
��������
�������ᾧ���ˮ���ȿɼӿ췴Ӧ���ʣ���Ҫ�����¶ȹ��߲���ֽ⣬Ȼ�����̼��ع��壬������KHC2O4����������ͭ�����Һ��50��ˮԡ���ȣ�Ϊ��ֹ�����������ȹ��ˣ���Һ������Ũ������ȴ�ᾧ�ɵõ�K2[Cu��C2O4��2]2H2O��
��1��������Ŀ������ϢH2C2O4![]() CO��+CO2��+H2O��֪�¶ȹ���ʹ����ֽ⣻
CO��+CO2��+H2O��֪�¶ȹ���ʹ����ֽ⣻
��2�����������֪��CuO��KHC2O4��Һ��50��ˮԡ���������·�Ӧ����K2[Cu��C2O4��2]��H2O����Ӧ�ķ���ʽΪ��2KHC2O4+CuO![]() K2[Cu��C2O4��2]+H2O��
K2[Cu��C2O4��2]+H2O��
��3��������Ŀ��Ϣ��֪{K2[Cu(C2O4)2]��2H2O}������ˮ����������ˮ�����Գ�ַ�Ӧ��Ӧ���ȹ��ˣ���߲��ʣ�����ѡC��
��4��{K2[Cu(C2O4)2]��2H2O}���ھƾ��������þƾ�ϴ��Ҳ���Լ��پ������ʧ��ͬʱ����ˮ��Ⱦƾ��ӷ������ڸ���������ͭ( II )��ؾ��壻
��5���ζ�ʱ����ҺӦʢ���ڵζ��������ҺӦʢ������ƿ�У��������Ϊǿ��������ҺӦʹ����ʽ�ζ��ܣ����¿�Ϊ�����ĵζ��ܣ���������ʵ�ӦΪB��
��6���õζ�������ͨ�������������Һȷ���������ͭ( II )��ؾ�������ʵ�������ƿ����ˮ�Եζ�û��Ӱ�죻
��7���ζ�������{K2[Cu(C2O4)2]��2H2O}��CԪ�ر���������CO2��ÿ��C���ϼ�����1�ۣ�������4�ۣ�KMnO4�е���Ԫ�ر���ԭ����Mn2+�����ϼ۽���5�ۣ����Դ���������ϵ5{K2[Cu(C2O4)2]��2H2O}~4 KMnO4����n��K2[Cu(C2O4)2]��2H2O��= V��10-3L��bmol��L-1��![]() ��
��![]() =12.5Vb��10-3mol�����Բ�Ʒ�Ĵ���Ϊ
=12.5Vb��10-3mol�����Բ�Ʒ�Ĵ���Ϊ![]() =
=![]() ��
��