题目内容
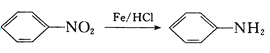
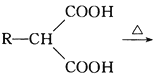
【题目】国家航天局计划2020年实施火星探测任务。据了解火星上存在大量的含氮化合物,科学家推测火星生命可能主要以氮、碳、硅、铜为基体构成。
请回答下列问题:
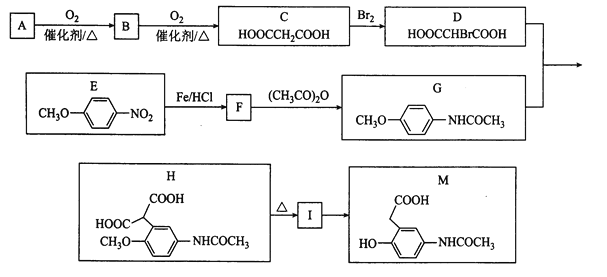
(1)邻氨基吡啶(![]() )的铜配台物在有机不对称合成中起催化诱导效应。
)的铜配台物在有机不对称合成中起催化诱导效应。
①邻氨基吡啶中所有元素的电负性出小到大的顺序为__(填元素符号)。设NA为阿伏加德罗常数的值,1mol![]() 中含有σ键的数目为__。
中含有σ键的数目为__。
②一定条件下-NH2可以被氧化成-NO2,-NO2中N原子的杂化方式为__杂化。
(2)第四周期的某主族元素,其第一至第五电离能数据如图所示,则该元素的基态原子电子排布式为___。

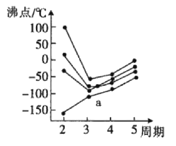
(3)元素周期表中的第IVA族~第VIIA族中部分元素的最简单氢化物的沸点变化趋势线如图,其中一个小黑点代表-种氢化物,则趋势线a代表第__族元素的最简单氢化物的沸点变化趋势,判断依据是__。
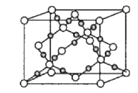
(4)干冰是常见的分子晶体,而CO2在高温高压下能形成另一种晶体其晶胞如图所示,该CO2晶体的熔点__(填“>”“<”或“=”)SiO2晶体的熔点。
(5)一种嘌呤和一种吡啶的结构如图。
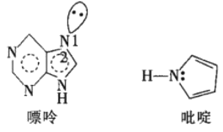
①嘌呤中轨道之间的夹角∠1比∠2大,原因是__。
②分子中的大π键可以用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡啶中的大π键可表示为__。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡啶中的大π键可表示为__。
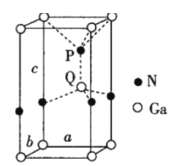
(6)火星岩石中存在大量的氮化镓,氮化镓为六方晶胞,结构如图所示。若该晶体密度为dg·cm-3,晶胞参数a=b≠c(单位:nm),a、b夹角为120°,阿伏加德罗常数的值为NA,则晶胞参数c=___nm(写出代数式)。
【答案】H<C<N 13NA sp2 1s22s22p63s23p64s2 IVA NH3、H2O、HF因存在氢键,沸点高于同主族相邻元素氢化物的,从而出现沸点反常现象,只有ⅣA族元素氢化物不存在反常现象,图中趋势线a没有反常现象 > 孤电子对与键合电子对之间的斥力大于键合电子对之间的斥力,斥力大 ![]()
![]()
【解析】
(1)①非金属性越强电负性越大;![]() 分子环上还有4个C-H将,分子含有13个σ键;
分子环上还有4个C-H将,分子含有13个σ键;
②-NO2中N原子有1个未成键电子,价层电子对数=2+1=3;
(2)根据图中该元素的第一至五电离能数据可知,该元素第三电离能突变,说明该元素容易失去2个电子,即最外层有两个电子,则为第IIA族元素Ca;
(3)含有氢键的氢化物熔沸点较高,不含氢键的氢化物熔沸点随着分子间作用力增大而增大;
(4)根据图知,CO2在高温高压下所形成的晶体为原子晶体,原子晶体熔沸点与原子半径成反比;
(5)①根据VSEPR理论,孤电子对与键合电子对之间的斥力大于键合电子对与键合电子对之间的斥力,导致键合电子对与对键合电子对之间的夹角减小;
②吡啶为平面结构,N形成3个共价键,未参与成键的p轨道有一对电子,参与形成离域大π键,每个C原子留有一个p轨道,轨道上留有一个单电子形成大π键;
(6)均摊法计算晶胞中Ga、N原子数目,表示出晶胞的质量,晶胞体积=a×10-7 cm×b×10-7 cm×sin60°×c×10-7 cm,结合晶胞质量=晶体密度×晶胞体积计算。
(1)①非金属性越强电负性越大,故电负性:H<C<N;![]() 分子环上还有4个C-H将,分子含有13个σ键,1mol
分子环上还有4个C-H将,分子含有13个σ键,1mol![]() 中含有σ键的数目为13NA,故答案为:H<C<N;13NA;
中含有σ键的数目为13NA,故答案为:H<C<N;13NA;
②-NO2中N原子有1个未成键电子,价层电子对数=2+1=3,N原子采取sp2杂化,故答案为:sp2;
(2)由该元素的第一至五电离能数据可知,该元素第一二电离能较小,说明容易失去2个电子,即最外层有两个电子,已知该元素为第四周期的某主族元素,则为第四周期,第IIA族元素Ca,则该元素的基态原子电子排布式为:1s22s22p63s23p64s2,故答案为:1s22s22p63s23p64s2;
(3)在ⅣA~ⅦA中的氢化物里,NH3、H2O、HF因存在氢键,故沸点高于同主族相邻元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象,组成与结构相似,相对分子量越大,分子间作用力越大,沸点越高,故曲线a点代表的应是第IVA的氢化物沸点变化,
故答案为:IVA;NH3、H2O、HF因存在氢键,沸点高于同主族相邻元素氢化物的,从而出现沸点反常现象,只有ⅣA族元素氢化物不存在反常现象,图中趋势线a没有反常现象;
(4)该晶体中原子之间通过共价键结合,属于原子晶体,而碳氧键的键长短,所以该晶体的熔点比SiO2晶体高,故答案为:>;
(5)①根据VSEPR理论,孤电子对对键合电子对之间的斥力大于键合电子对对键合电子对之间的斥力,导致键合电子对对键合电子对之间的夹角减小,故答案为:孤电子对与键合电子对之间的斥力大于键合电子对之间的斥力,斥力大;
②吡啶为平面结构,N形成3个共价键,未参与成键的p轨道有一对电子,参与形成离域大π键,每个C原子留有一个p轨道,轨道上留有一个单电子形成大π键,所以吡啶环形成5中心6电子的离域大π键:![]() ,故答案为:
,故答案为:![]() ;
;
(6)晶胞中Ga原子数目=1+8×![]() =2、N原子数目=1+4×
=2、N原子数目=1+4×![]() =2,故晶胞质量=2×
=2,故晶胞质量=2×![]() g,晶胞体积=a×10-7 cm×b×10-7 cm×sin60°×c×10-7 cm,则:2×
g,晶胞体积=a×10-7 cm×b×10-7 cm×sin60°×c×10-7 cm,则:2×![]() g=(a×10-7 cm×b×10-7 cm×sin60°×c×10-7 cm)×dgcm3,解得c=
g=(a×10-7 cm×b×10-7 cm×sin60°×c×10-7 cm)×dgcm3,解得c=![]() ,故答案为:
,故答案为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某学习小组通过下列装置探究MnO2与FeCl36H2O能否反应产生Cl2。
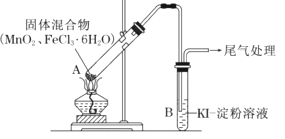
资料:FeCl3是一种共价化合物,熔点306℃,沸点315℃。
ⅰ.实验操作和现象:
操作 | 现象 |
点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
ⅱ.分析现象的成因:
(1)现象i中的白雾是______,用化学方程式和必要的文字说明白雾的形成原因是______。
(2)分析现象ii,该小组探究黄色气体的成分,实验如下:
a.直接加热FeCl3·6H2O,产生白雾和黄色气体。
b.将现象ii和a中的黄色气体通入KSCN溶液,溶液均变红。通过该实验说明现象ii中黄色气体含有______。
(3)除了氯气可使B中溶液变蓝外,该小组还提出其他两种可能的原因:
可能原因①:实验b检出的气体使之变蓝;
反应的离子方程式是______。
可能原因②:______;
反应的离子方程式是______。
(4)为进一步确认黄色气体中是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1 | 在A、B间增加盛有某种试剂的洗气瓶C | B中溶液变为蓝色 |
方案2 | 将B中KI-淀粉溶液替换为NaBr溶液;检验Fe2+ | B中溶液呈浅橙红色;未检出Fe2+ |
①方案1的C中盛放的试剂是______,从化学平衡原理的角度加以解释______。
②方案2中检验Fe2+的最佳试剂是______,若存在Fe2+,则现象是______。
③综合方案1、2的现象,说明方案2中选择NaBr溶液的依据是______。
(5)将A中产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是______。