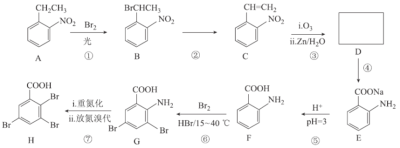
题目内容
【题目】科学家们已研发出硅负极锂离子电池,在相同体积中,硅负极电池容量比石墨碳电池容量提升25%,反应原理为5LiMn2O4+Si![]() 5Li0.12Mn2O4+Li4.4Si,LiPF6纯液体作电解质,下列有关说法正确的是( )
5Li0.12Mn2O4+Li4.4Si,LiPF6纯液体作电解质,下列有关说法正确的是( )
A.放电时的负极反应为Li﹣e﹣=Li+
B.若用该电池电解水,阴极生成3.52gO2,则该电池负极质量减少0.77g
C.锂离子电池充电时的阴极反应为Si+4.4e-+4.4Li+=Li4.4Si
D.放电时电解质LiPF6水溶液中的Li+移向正极
【答案】AC
【解析】
A.根据放电时的电池反应,负极上是失电子的氧化反应,Li﹣e-=Li+,故A正确;
B.若用该电池电解水,阴极生成3.52g即0.22molO2,根据电极反应:4OH-﹣4e-═2H2O+O2↑,转移电子是0.88mol,根据负极反应:Li﹣e-=Li+,该电池负极质量减小0.88mol×7g/mol=6.16g,故B错误;
C.锂离子电池充电时,阴极发生得电子的还原反应,阴极反应为Si+4.4e-+4.4Li+=Li4.4Si,故C正确;
D.LiPF6纯液体作电解质,不是水溶液,故D错误;
故答案为:AC。

练习册系列答案
相关题目