题目内容
13.元素周期表有七个横行,叫周期,从左到右元素的金属性减弱(填增强或减弱);元素周期表中有18列,分为16 族,第ⅥA族处在第16列.分析 元素周期表的结构:七个周期,十六个族,每一行电子层数相同,每主族元素原子最外层电子数相等,根据周期和族的分布以及元素周期表中的递变规律知识来回答.
解答 解:元素周期表的结构:7个行即七个周期,18个列,即十六个族,第ⅥA族处在第16列,每一周期中电子层数相同,每一周期中的元素从左到右元素的金属性减弱,
同主族元素原子最外层电子数相等,同一主族从上到下,元素的非金属性依次减弱,第ⅥA族处在第16列,故答案为:七;减弱;18;16;16.
点评 本题考查学生元素周期表的结构和元素性质的递变规律知识,可以根据所学内容来回答,难度不大.

练习册系列答案
相关题目
3.配制一定物质的量浓度的KOH溶液时,导致所配溶液浓度偏低的原因可能是( )
| A. | 定容时俯视 | B. | 容量瓶中原有少量的蒸馏水 | ||
| C. | 容量瓶盛过KOH溶液,使用前未洗涤 | D. | 转移时,不慎将液体流到瓶外 |
4.下列物质与NaOH醇溶液共热完全反应后,可得3种有机物的是( )
| A. | CH3-CHCl-CH2-CH3 | B. | 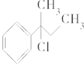 | ||
| C. | CH3-C(CH3)Cl-CH2-CH3 | D. | 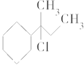 |
1.下表给出几种氢化物的熔点和沸点:
有关表中所列四种氢化物的性质,以下叙述正确的是:( )
①氯化铝在加热时能升华,
②四氯化硅在晶态时属于分子晶体,
③氯化钠晶体中粒子之间以范德华力结合,
④氯化镁的熔沸点比氯化钠低,主要是受堆积方式,键的极性、品格能等影响.
| NaCl | MgCl2 | AlCl3 | SiCl4 | |
| 熔点/℃ | 801 | 714 | 190 | -70 |
| 沸点/℃ | 1 413 | 1 412 | 180 | 57.57 |
①氯化铝在加热时能升华,
②四氯化硅在晶态时属于分子晶体,
③氯化钠晶体中粒子之间以范德华力结合,
④氯化镁的熔沸点比氯化钠低,主要是受堆积方式,键的极性、品格能等影响.
| A. | ② | B. | ③④ | C. | ①②④ | D. | ①②③④ |
8.下列关于化学键的说法正确的是( )
| A. | 由非金属元素组成的化合物不一定是共价化合物 | |
| B. | 非极性键只存在于双原子分子中 | |
| C. | 构成单质分子的微粒一定含有共价键 | |
| D. | 不同元素组成的多原子分子里的化学键一定是极性键 |
18.下列说法正确的是( )
| A. | $\stackrel{235}{92}$U和$\stackrel{238}{92}$U是中子数不同质子数相同的同种核素 | |
| B. | 同种元素的原子均有相同的质子数和中子数 | |
| C. | 质子数为53,中子数为78的碘原子:$\stackrel{131}{53}$I | |
| D. | 通过化学变化可以实现16O与18O间的相互转化 |
5.下列反应产物中,一定不存在同分异构体的反应是( )
| A. | 异戊二烯( )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 丁烷与氯气光照条件下生成的一氯代物 | |
| C. | 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 | |
| D. | 2-丁烯与水的加成反应 |
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,11.2L CCl4中含有的分子数目为0.5NA | |
| B. | 1mol CH${\;}_{5}^{+}$中含有的电子数目为11NA | |
| C. | 28g聚乙烯中含有的碳原子数目为2NA | |
| D. | 0.1mol•L-1 MgCl2溶液中含有的Mg2+数目一定小于0.1NA |
3.酒精分析器是交警检测驾驶员否饮酒的仪器,其原理是酒精与CrO3反应生成蓝绿色的Cr3+.根据颜色变化能判断是否饮过酒及饮酒量的多少.下列对乙醇性质的描述与此测定原理无关的是( )
| A. | 沸点低 | B. | 密度比水小 | C. | 乙醇溶于水 | D. | 具有还原性 |