题目内容
【题目】乙烯是合成纤维、合成橡胶、合成塑料、合成乙醇的基本化工原料。回答下列问题:
(1)实验室快速制取少量乙烯可用乙烯利(![]() )与NaOH溶液反应制取。写出该反应的化学方程式为________(磷转化为磷酸正盐)。
)与NaOH溶液反应制取。写出该反应的化学方程式为________(磷转化为磷酸正盐)。
(2)乙烷裂解制备乙烯越来越受到石化企业的重视。已知部分热化学方程式如下:
Ⅰ.C2H6(g)=C2H4(g)+H2(g) △H1=+137kJ·mol-1
Ⅱ.CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+42kJ·mol-1
Ⅲ.C2H6(g)+CO2(g)=C2H4(g)+CO(g)+H2O(g) △H3
①反应Ⅲ的△H3=________kJ·mol-1。
②若在1273K时,100kPa下反应(Ⅰ)达到平衡时,混合气体中C2H4、C2H6、H2的物质的量分别为0.047、0.006、0.047,则乙烯的分压为p(C2H4)=________kPa;平衡常数Kp=________(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
③恒温恒容密闭容器中进行的反应(Ⅱ),能说明已达到平衡状态的是________(填字母)。
a.压强不再随时间变化 b.混合气体密度不再随时间变化
c.v(H2)正=v(CO)逆 d.单位时间内断裂C=O的数目与断裂H-O的相等
④乙烷直接裂解以及与CO2耦合裂解可能发生的反应及平衡转化率(α)与温度(T)的关系分别如下图所示,已知:a.C2H6=C2H4+H2;b.C2H6+CO2=C2H4+CO+H2O;c.C2H6+2CO2=4CO+H2;d.2C2H6+CO2=C2H4+2CO+2H2+CH4;e.16C2H6+9CO2=14C2H4+12CO+12H2+6H2O+CH4。

下列说法正确的是________(填字母)。
a.600℃以下,反应a的趋势最大
b.CO2和C2H6耦合裂解有利于提高乙烷的平衡转化率
c.过量CO2和C2H6耦合高温裂解,可较好防止催化剂表面结炭
d.用合适的催化剂催化CO2和C2H6耦合裂解,可提高反应平衡常数
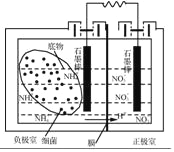
(3)以太阳能电池为电源,利用电解法也可实现CO2制备乙烯,其装置如图所示。电极a为电源的________(填“正极”或“负极”),生成乙烯的电极反应式为________。

【答案】![]() +179 47 368.2 cd bc 负极 2CO2+12H++12e-=CH2=CH2+4H2O
+179 47 368.2 cd bc 负极 2CO2+12H++12e-=CH2=CH2+4H2O
【解析】
(2)①利用盖斯定律;
②分压=物质的量分数![]() 总压,代入平衡常数表达式可解;
总压,代入平衡常数表达式可解;
③紧扣“逆向相等,变量不变”判断平衡状态;
(3)与电源负极相连的是阴极,得到电子,发生还原反应。
(1)用![]() 与NaOH溶液反应制取少量乙烯,且磷转化为磷酸正盐即Na3PO4。综上该反应的化学方程式为:
与NaOH溶液反应制取少量乙烯,且磷转化为磷酸正盐即Na3PO4。综上该反应的化学方程式为:![]() ;
;
(2)①反应Ⅲ=反应Ⅰ+反应Ⅱ,则△H3=△H1+△H2=+179kJ·mol-1。
②在1273K时,100kPa下反应(Ⅰ)达到平衡时,混合气体中C2H4、C2H6、H2的物质的量分别为0.047、0.006、0.047,乙烯的分压为p(C2H4)=![]() =
=
47kPa;p(C2H6)=6 kPa,p(H2)=47kPa,平衡常数Kp=![]() =368.2 kPa;
=368.2 kPa;
③a.反应(Ⅱ)反应前后气体数目不变,压强一直恒定,故压强不再随时间变化不能说明已达到平衡状态,故a错误;
b.反应物和生成物全是气体,由质量守恒可知气体质量不变。且恒容密闭容器,由密度=气体质量![]() 容器体积,可知密度一直恒定,故混合气体密度不再随时间变化不能说明已达到平衡状态,故b错误;
容器体积,可知密度一直恒定,故混合气体密度不再随时间变化不能说明已达到平衡状态,故b错误;
c.v(H2)正=v(CO)逆,一正一逆反应速率,且符合方程式的化学计量数之比,能说明已达到平衡状态,故c正确;
d.单位时间内断裂C=O(正反应方向)的数目与断裂H-O(逆反应方向)的相等,且符合方程式的断键数目之比,能说明已达到平衡状态,故d正确;
答案选cd。
④a.600℃以下,反应e的α(C2H6)最大,故反应e的趋势最大,故a错误;
b.CO2和C2H6耦合裂解,可将C2H6转化为其他气体燃料,如CO和CH4,有利于提高乙烷的平衡转化率,故b正确;
c.过量CO2和C高温会反应为CO,可较好防止催化剂表面结炭,故c正确;
d.平衡常数仅受温度影响,催化剂不会改变平衡常数,故d错误;
答案选bc。
(3)与电极a相连的电极上CO2转化为乙烯,碳元素的化合价降低,得到电子,发生还原反应,作为阴极,故电极a为电源的负极,生成乙烯的电极反应式为2CO2+12H++12e-=CH2=CH2+4H2O。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案