题目内容
【题目】硫、铁及其化合物用途非常广泛。回答下列问题:
(1)基态S原子价电子排布式为________,基态Fe原子未成对电子数为________个。
(2)团簇 中,S、C、N的化合价依次为-2、+2、-3,Fe2+与Fe3+数目之比为________;与铁形成配位键的原子是________。
中,S、C、N的化合价依次为-2、+2、-3,Fe2+与Fe3+数目之比为________;与铁形成配位键的原子是________。
(3)工业上主要通过反应SO3+SCl2=SOCl2+SO2制备SOCl2(氯化亚砜),上述四种分子中,属于非极性分子的是________;SCl2分子空间构型为________形;SOCl2分子中心原子杂化方式是________。
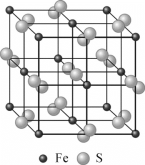
(4)黄铁矿的晶体结构如图所示,已知黄铁矿晶胞参数为a=0.5417nm,阿伏加德罗常数的值为NA。则黄铁矿的密度为________g·cm-3(列出计算式)。
【答案】3s23p4 4 3︰1 S和C SO3 V sp3 ![]()
【解析】
(1)主族元素的价电子排布式即最外层电子排布式,未成对电子数目看最外层电子的轨道排布式;
(2)列原子守恒、化合价的方程组可解;
(3)由中心原子的化合价与元素最高正价的关系可快速判断分子类型,由中心原子的价层电子对数可判断杂化类型,结合孤电子对数可判断空间构型;
(4)求密度公式:![]() 。
。
(1)S是第16号元素,位于元素周期表的第三周期第VIA族,故其价电子排布式为3s23p4,基态Fe原子价电子排布式为3d64s2,由3d轨道电子排布图可知,未成对电子数为4个;
(2)团簇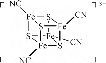 中,S、C、N的化合价依次为-2、+2、-3,则-CN的化合价为-1,设Fe2+数目为x,Fe3+数目为y,则有①x+y=4 ②2x+3y=9(化合价代数和等于所带电荷)。解得x=3,y=1。则Fe2+与Fe3+数目之比为3︰1。铁原子提供空轨,与C和S形成配位键;
中,S、C、N的化合价依次为-2、+2、-3,则-CN的化合价为-1,设Fe2+数目为x,Fe3+数目为y,则有①x+y=4 ②2x+3y=9(化合价代数和等于所带电荷)。解得x=3,y=1。则Fe2+与Fe3+数目之比为3︰1。铁原子提供空轨,与C和S形成配位键;
(3)SO3中硫元素的化合价为+6,硫原子最外层6个电子全部成键,属于非极性分子;SCl2价层电子对数=![]() =4,孤电子对数=4-2=2,则分子空间构型为V形;SOCl2价层电子对数=4,分子中心原子杂化方式是sp3;
=4,孤电子对数=4-2=2,则分子空间构型为V形;SOCl2价层电子对数=4,分子中心原子杂化方式是sp3;
(4)已知黄铁矿晶胞参数为a=0.5417nm=0.5417![]() cm,则黄铁矿的密度为:
cm,则黄铁矿的密度为:![]() g·cm-3。
g·cm-3。