��Ŀ����
����Ŀ����ˮ�й����İ���(NH3��NH4+)�ᵼ��ˮ�帻Ӫ������ij����С����NaClO����������������ˮ����֪����HClO�������Ա�NaClOǿ����NH3��NH4+���ױ��������۹��ұ�Ҫ�������İ�����ˮpHҪ������6��9��
(1)pH��1.25ʱ��NaClO����NH4+��Ӧ����N2������Ⱦ���ʣ��÷�Ӧ�����ӷ���ʽΪ_____��
(2)��ˮpH����ȥ���ʺͳ�ˮpH��Ӱ������ͼ��ʾ

�ٽ�ˮpHΪ1.25��2.75��Χ�ڣ�����ȥ������pH����Ѹ���½���ԭ����_____
�ڽ�ˮpHΪ2.75��6.00��Χ�ڣ�����ȥ������pH���߶�������ԭ����_____
�۽�ˮpHӦ������_____����Ϊ�ˡ�
(3)Ϊ�о�������NaClO����������Ӱ�죬�����������䣬�����ӵ�λʱ����ͨ��������������ְ���ȥ���ʼ������䡣��ԭ�������_____(����ĸ)��
a��O2�������Ա�NaClO�� b��O2�����������ʱ�NaClO��
c��O2����Һ���ܽ�ȱȽ�С d�������е�N2������Һ��
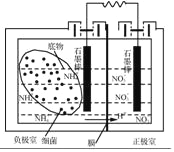
(4)��������ȼ�ϵ�ؿ��Զ�����ˮ���д�������װ����ͼ��ʾ���պϵ�·�������������Ҿ�����������������NH4+������Ӧ�ĵ缫��ӦʽΪ_____����װ�ó����ܶ�����ˮ���д����⣬��һ��ͻ�����ŵ���_____��
���𰸡�3ClO����2NH4+===N2����3Cl����3H2O��2H��(��3HClO��2NH4+===N2����3Cl����3H2O��5H��) ����pH���ߣ�NaClO���������������ܽ��ͣ����°���ȥ�����½� ����pH���ߣ�������ˮ��NH3�������������ױ����� 1.50 abc 2NH4+��6e��===N2����8H�� ����ѧ��ת��Ϊ����(���ܴ�����̬����ˮ)
��������
��1����Ԫ�ػή�͵�-1�ۣ��ٸ���������ԭ��Ӧ������ƽ��д���ӷ���ʽ��
��2����ϸ�������֪��Ϣ����Һ����֮��Ĺ�ϵ��ͼ��仯��������
��3���ӿ����е����������������������ؿ��ǣ�
��4������ԭ���ԭ����������笠�����ʧ���ӷ���������Ӧ���ܷ�Ӧ����ѧ��ת��Ϊ���ܡ�
��1��pH��1.25ʱ��NaClO��Һ�������ԣ���Һ�л��д����ᣬ������NH![]() ��Ӧ����N2�������Ӻ������ӣ������ӷ���ʽΪ��3ClO����2NH4+===N2����3Cl����3H2O��2H������3HClO��2NH4+===N2����3Cl����3H2O��5H������
��Ӧ����N2�������Ӻ������ӣ������ӷ���ʽΪ��3ClO����2NH4+===N2����3Cl����3H2O��2H������3HClO��2NH4+===N2����3Cl����3H2O��5H������
�ʴ�Ϊ��3ClO����2NH4+===N2����3Cl����3H2O��2H������3HClO��2NH4+===N2����3Cl����3H2O��5H������
��2����HClO�������Ա�NaClOǿ����ˮpHΪ1.25��2.75��Χ�ڣ���pH���ߣ�HClO������Խ��ͣ���NaClO�������������������ܽ��ͣ����°���ȥ�����½���
�ʴ�Ϊ������pH���ߣ�NaClO���������������ܽ��ͣ����°���ȥ�����½���
�ڽ�ˮpHΪ2.75��6.00��Χ�ڣ���pH���ߣ��ٽ�笠�����ˮ�⣬ʹ�����ɷ�����笠�����Ũ�Ƚ��ͣ����ݸ�����Ϣ����֪��NH3��NH![]() ���ױ��������ʵ��°���ȥ�������ߣ�
���ױ��������ʵ��°���ȥ�������ߣ�
�ʴ�Ϊ������pH���ߣ�������ˮ��NH3�������������ױ�������
�۰��չ��ұ�Ҫ���������İ�����ˮpHҪ������6��9����Ͻ�ˮpH�Գ�ˮpH��Ӱ�����߿�֪������ˮpHҪ������6��9�����ˮpHΪ1.5-2.1���ٸ��ݽ�ˮpH1.25��2.75��Χ�ڶ���ȥ���ʵ�Ӱ���ۺϿ��ǣ���ѡ���ˮpHӦ������1.50����Ϊ�ˣ�
�ʴ�Ϊ��1.50��
��3�������ӵ�λʱ����ͨ��������������ְ���ȥ���ʼ������䣬��������ΪO2�������Ա�NaClO����O2�����������ʱ�NaClO����O2����Һ���ܽ�ȱȽ�С����abc����ȷ��������������ˮ��d��˵������
�ʴ�Ϊ��abc��
��4������ԭ���ԭ����ϵ������ҺΪ���ӽ���Ĥ������笠�����ʧ�������ɵ���������������Ӧ����缫��ӦʽΪ��2NH4+��6e��===N2����8H��������������ԭ��ӦҲ���ɵ������ﵽ������ˮ���д�����Ŀ�ģ��һ��ܽ���ѧ��ת��Ϊ���ܣ��Ǹ�ȼ�ϵ��װ��ͻ�����ŵ㣬
�ʴ�Ϊ��2NH4+��6e��===N2����8H��������ѧ��ת��Ϊ����(���ܴ�����̬����ˮ)