题目内容
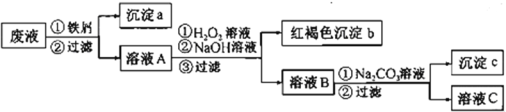
【题目】金属钒被誉为“合金的维生素”。从废钒(主要成分为V2O5、Fe2O3、SiO2等)中回收V2O5的一种工艺流程如下图所示:

已知:
步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层)![]() RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
回答下列问题:
(1)步骤D酸浸过程中发生氧化还原反应的化学方程式为______________________。
(2)萃取时应加入适量碱的作用是___________________。
(3)步骤④中反应的离子方程式为___________________。
(4)步骤⑤加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<_____mol/L(按25℃计算,25℃时Ksp[Fe(OH)3]=2.6×10-39)。所得NH4VO3为离子化合物,NH4+的电子式为_______。
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为V0+,则V2O5与氢碘酸反应的离子方程式为_________________。
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=_______mol/L(萃取的量=![]() )
)
【答案】 V2O5+K2SO3+2H2SO4=K2SO4+2VOSO4+2H2O )加入碱中和产生的酸,使平衡向RAn移动,提高钒的萃取率 ClO3-+6VO2++3H2O=6VO2++Cl-+6H+ 2.6×l0-3 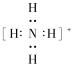 V2O5+6H++4I-=2VO++2I2+3H2O 1.6a×l0-3
V2O5+6H++4I-=2VO++2I2+3H2O 1.6a×l0-3
【解析】(1).SiO2不溶于硫酸,铁离子的化合价没有改变,所以亚硫酸根被氧化,而V2O5被还原为VO2+,方程式为:V2O5+K2SO3+2H2SO4=K2SO4+2VOSO4+2H2O;
(2).与反应生成的氢离子反应,使反应向正向移动,提高RAn的生产率,增加萃取量;
(3). VO2+被氧化为VO2+,ClO3-被还原为 Cl-,所以离子方程式为:ClO3-+6VO2++3H2O=6VO2++Cl-+6H+;
(4).当pH=2时,c(OH-)=1.0×10-12mol/L,此时![]() ,所以c(Fe3+)<2.6×l0-3mol/L;NH4+的电子式为
,所以c(Fe3+)<2.6×l0-3mol/L;NH4+的电子式为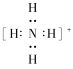 ;
;
(5).反应物为V2O5、H+及I-,生成物为V0+,I2,离子方程式为:V2O5+6H++4I-=2VO++2I2+3H2O
(6). c(VO2+)=a0.24mol/L=1.6a×l0-3 mol/L。