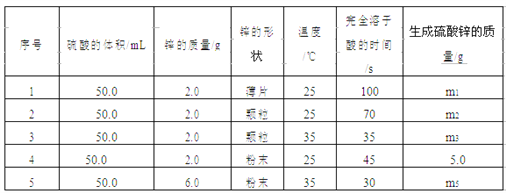
题目内容
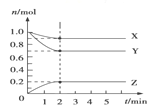
【题目】(题文)在0.4 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。

(1)该混合液中,NaCl的物质的量为______mol,含溶质MgCl2的质量为________g。
(2)该混合液中CaCl2的物质的量为________mol,将该混合液加水稀释至体积为1 L,稀释后溶液中Ca2+的物质的量浓度为________mol·L1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀________mol。
【答案】 0.4 19.0 0.2 0.2 1.2
【解析】
试题(1)根据图像可知钠离子的浓度是1.0mol/L,所以溶液中氯化钠的浓度是1.0mol/L,所以该混合液中,NaCl的物质的量为1.0mol/L×0.4L=0.4mol.;溶液中镁离子的浓度是0.5mol/L,所以溶液中氯化镁的浓度是0.5mol/L,则含溶质MgCl2的质量为0.4L×0.5mol/L×95g/mol=19.0g。
(2)溶液中氯离子的浓度是3.0mol/L,所以根据溶液显电中性可知溶液中钙离子的浓度是(3.0mol/L-1.0mol/L-2×0.5mol/L)÷2=0.5mol/L,因此该混合液中CaCl2的物质的量为0.5mol/L×0.4L=0.2mol。将该混合液加水稀释至体积为1 L,由于稀释后溶质的物质的量不变,则稀释后溶液中Ca2+的物质的量浓度为![]() 。
。
(3)溶液中氯离子的物质的量是0.4L×3mol/L=1.2mol,所以根据方程式Ag++Cl-=AgCl↓可知向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到氯化银沉淀的物质的量是1.2mol。

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目