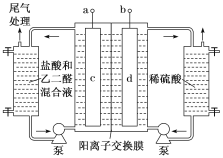
题目内容
【题目】设 NA 表示为阿伏加德罗常数,下列叙述中,正确的是( )
A.常温常压下,16 g O2和O3的混合物中共含有NA个氧原子
B.假设1 mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA
C.78 g Na2O2 固体中所含阴、阳离子总数为4NA
D.在铜与硫有反应中,1 mol铜原子参加反应失去的电子数为2NA
【答案】A
【解析】
A. O2和O3都是由O原子构成,16 g O2和O3的混合物中含氧原子物质的量n(O)=![]() =1 mol,则含O原子的数目为NA个,A正确;
=1 mol,则含O原子的数目为NA个,A正确;
B. 氯化铁完全转化为氢氧化铁胶体,由于胶粒是许多Fe(OH)3的集合体,则1 mol氯化铁水解产生胶体微粒数小于NA,B错误;
C. 78 g Na2O2固体物质的量为1 mol,其中含2 mol Na+,1 mol O22﹣,含离子总物质的量是3 mol,C错误;
D. Cu与S发生反应生成Cu2S,铜元素化合价从0价变化为+1价,1 mol Cu原子参加反应失去 1 mol电子,故转移的电子数为NA,D错误;
故合理选项是A。

【题目】(1)葡萄酒中SO2最大使用量为0.25 g·L-1,取300.00 mL葡萄酒,通过适当的方法使 所含SO2全部逸出并用H2O2将其全部氧化为H2SO4,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定。
①滴定前排气泡时,应选择下图中的________(填序号)。
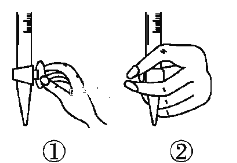
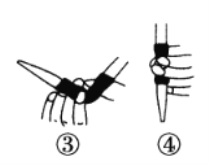
②若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积___(填序号)。
①=10 mL ②=40 mL ③<10 mL ④>40 mL。
③上述滴定实验中,可选择___为指示剂,选择该指示剂时如何判断反应到达滴定终点:_____。
④滴定终点读数时俯视刻度线,则测量结果比实际值________(填“偏高”、“偏低”或“无影响”)。
(2)某学生用0.100molL-1的KOH标准溶液滴定未知浓度的盐酸,其操作为:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管下面,用标准KOH溶液滴定至终点并记下刻度。
实验编号 | KOH溶液的浓度(mol/L) | 滴定完成时,KOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①正确操作步骤的顺序是(用序号字母填写)___________________________
②根据上述数据,可计算出该盐酸的浓度约为______________(保留两位有效数字)。