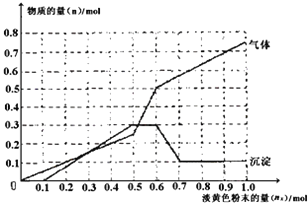
题目内容
【题目】已知NaHC2O4溶液的pH < 7。常温下,向pH=8.4的Na2C2O4溶液中滴加0.1mol/L的HCl溶液,溶液pH与pOH[pOH=-lgc(OH-)]的变化关系如图所示,下列各点所示溶液中微粒的物质的量浓度关系一定正确的是

A. a点:c(H+)+c(HC2O4-)+2c(H2C2O4)=c(OH-)
B. b点:c(Cl-)>c(H2C2O4)+c(HC2O4-)+c(C2O42-)
C. c点:c(Na+)=c(HC2O4-)+ c(C2O42-)+c(Cl-)
D. d点:c(OH-)+ c(Cl-)>c(H+)+2c(H2C2O4)
【答案】AD
【解析】A、Na2C2O4溶液的质子守恒,水电离出的n(H+)=n(OH-),在草酸钠水溶液中水电离出的氢离子以(H+,HC2O4-,H2C2O4)三种形式存在,其中1mol草酸分子中有2mol水电离出的氢离子,所以c(H+)+c(HC2O4-)+2c(H2C2O4)=c(OH-),故A正确;B、b点时,溶液为NaHC2O4,根据物料守恒,c(Cl-)=c(H2C2O4)+c(HC2O4-)+c(C2O42-),故B错误;C、电荷守恒为c(Na+)=c(HC2O4-)+ c(C2O42-)×2+c(Cl-),故C错误;D、根据物料守恒,c(Na+ )=2c(H2C2O4)+2c(HC2O4-)+2c(C2O42-),电荷守恒为c(H+)+c(Na+)=c(OH― )+c(HC2O4-)+ c(C2O42-)×2+c(Cl-),
2c(H2C2O4)+2c(HC2O4-)+2c(C2O42-)+c(H+)=c(OH― )+c(HC2O4-)+ c(C2O42-)×2+c(Cl-)
即:2c(H2C2O4)+c(HC2O4-)+c(H+)=c(OH― )+c(Cl-),故c(OH-)+ c(Cl-)>c(H+)+2c(H2C2O4)正确;故选AD。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】化学在生产、生活中有广泛应用,下列对应关系不正确的是
化学性质 | 实际应用 | |
A | SO2具有漂白性 | 用SO2漂白纸浆 |
B | Fe3+水解生成胶体 | 硫酸铁可用作净水剂 |
C | 维生素C易被氧气氧化 | 维生素C用作食品抗氧化剂 |
D | 硫酸是一种强酸 | 硫酸可用于除去锅炉中的水垢 |
A. A B. B C. C D. D
【题目】已知:下表为25℃时某些弱酸的电离平衡常数。
CH3COOH | HClO | H2CO3 |
Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
下图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是 ( )
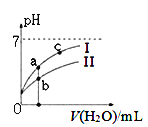
A. 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+) > c(ClO-)> c(CH3COO-)> c(OH-)> c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为: ClO-+CO2+ H2O =HClO+CO32-
C. 图像中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D. 图像中a点酸的总浓度大于b点酸的总浓度