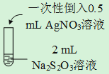题目内容
【题目】下列图示装置所表示的实验中,没有发生氧化还原反应的是
|
|
|
|
A.蘸有浓盐酸和浓氨水的玻璃棒靠近 | B.铝丝伸入硫酸铜溶液中 | C.测定空气中氧气含量 | D.向蔗糖中加入浓硫酸 |
A.AB.BC.CD.D
【答案】A
【解析】
A.蘸有浓盐酸和浓氨水的玻璃棒靠近,氨气与氯化氢反应生成氯化铵,反应无化合价变化,不发生氧化还原反应,A正确;
B.铝丝伸入硫酸铜溶液中,发生反应2Al+3Cu2+=3Cu+2Al3+,有化合价变化,发生氧化还原反应,B错误;
C.利用某些物质(如:磷)与空气中氧气反应(不生成气体,生成固体),使容器内压强减小,测定进入容器内水的体积,即为空气中氧气的体积,发生氧化还原反应,C错误;
D.浓硫酸能将蔗糖中的H、O元素以2:1脱去,自身被还原成二氧化硫,发生氧化还原反应,D错误;
答案选A。

【题目】异丁烷脱氢制异丁烯反应为:![]()
副反应为裂解反应:![]()
![]() 已知:
已知:
化学键 | | | | |
键能 | 412 | 348 | 612 | 436 |
试计算异丁烷脱氢反应的![]() ______
______![]()
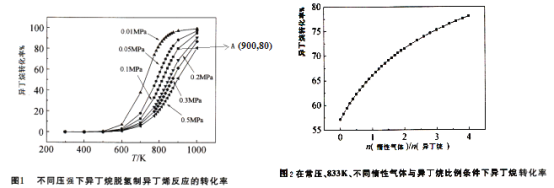
![]() 不同压强条件下异丁烷脱氢反应的转化率如图1所示。下列说法不正确的是______。
不同压强条件下异丁烷脱氢反应的转化率如图1所示。下列说法不正确的是______。
A.主反应和副反应均在低温条件下自发
B.开发高选择性的催化剂,有效抑制副反应的发生,可提高异丁烯的选择性
C.由图1可知,![]() 范围内,温度不变,压强增大,异丁烷脱氢反应的转化率降低
范围内,温度不变,压强增大,异丁烷脱氢反应的转化率降低
D.选择合适的温度,使催化剂的活性最大,有利于提高异丁烷的平衡转化率
![]() 平衡常数的表达式中平衡浓度可以用平衡时各气体的分压代替
平衡常数的表达式中平衡浓度可以用平衡时各气体的分压代替![]() 分压
分压![]() 物质的量分数
物质的量分数![]() 总压强
总压强![]() 。图1中,A点状态下的异丁烷脱氢反应的平衡常数
。图1中,A点状态下的异丁烷脱氢反应的平衡常数![]() ______
______![]() 保留两位有效数字
保留两位有效数字![]() 。
。
![]() 常压、833K条件下,异丁烷脱氢制异丁烯的转化率随着惰性气体与异丁烷比例的变化情况如图2,请解释随着惰性气体与异丁烷比例的增加,异丁烷转化率逐渐增加的原因:______。
常压、833K条件下,异丁烷脱氢制异丁烯的转化率随着惰性气体与异丁烷比例的变化情况如图2,请解释随着惰性气体与异丁烷比例的增加,异丁烷转化率逐渐增加的原因:______。
![]() 请在图2中画出温度为
请在图2中画出温度为![]() ,其他条件不变时,异丁烷转化率图象。
,其他条件不变时,异丁烷转化率图象。
![]() 科学家发现,以
科学家发现,以![]() 和
和![]() 为原料,熔融
为原料,熔融![]() 为电解质,纳米
为电解质,纳米![]() 作催化剂,在
作催化剂,在![]() 和常压下可实现电化学合成氨。阴极区发生的变化可视为按两步进行,请补充完整。电极反应式:______和
和常压下可实现电化学合成氨。阴极区发生的变化可视为按两步进行,请补充完整。电极反应式:______和![]() 。
。
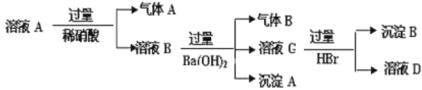
【题目】“硫代硫酸银”( [ Ag(S2O3)2]3–)常用于切花保鲜,由AgNO3溶液(0.1 mol·L–1 、pH=6)和Na2S2O3溶液(0.1 mol·L–1、pH=7)现用现配制。某小组探究其配制方法。
(实验一)
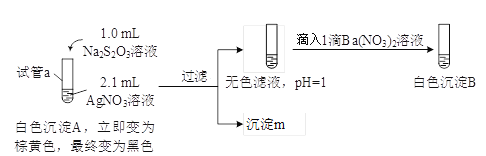
(1)A为Ag2S2O3。写出生成A的离子方程式__________。
(2)对实验现象的分析得出,试管a中充分反应后一定生成了__________(填离子符号)。进而推测出沉淀m可能为Ag2S、Ag、S或它们的混合物。做出推测的理由是__________。
(3)若试管a中物质充分反应后不过滤,继续加入1.1 mL Na2S2O3溶液,振荡,静置,黑色沉淀不溶解,清液中逐渐出现乳白色浑浊,有刺激性气味产生。用离子方程式解释产生白色浑浊的原因:__________。
结论:Ag2S2O3不稳定,分解所得固体不溶于Na2S2O3溶液。
(实验二)已知:Ag2S2O3 +3S2O32- ![]() 2 [ Ag(S2O3)2]3–(无色)
2 [ Ag(S2O3)2]3–(无色)
实验操作 | 实验现象 |
i. | 白色沉淀生成,振荡后迅速溶解,得到无色清液; 滴加至约1 mL时清液开始略显棕黄色,有丁达尔现象; 超过1.5 mL后,产生少量白色沉淀,立即变为棕黄色,最终变为黑色; 滴加完毕,静置,得到黑色沉淀,上层清液pH = 5 |
ii. | 白色沉淀生成,立即变为棕黄色,充分振荡后得到棕黄色清液,有丁达尔现象。 |
(4)用平衡移动原理解释实验i中加入1.5 mL AgNO3后产生白色沉淀的原因:__________。
(5)实验i中,当加入0.5 mL AgNO3溶液时,得到无色清液,若放置一段时间,无明显变化。结合化学反应速率分析该现象与ii不同的原因是__________。
(6)简述用0.1 mol·L–1 AgNO3溶液和0.1 mol·L–1 Na2S2O3溶液配制该保鲜剂时,试剂的投料比和操作:__________。