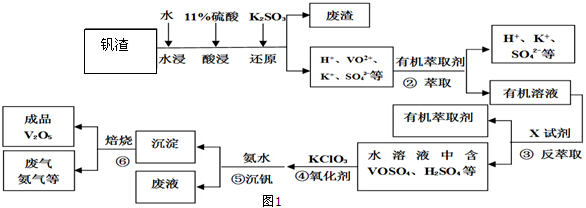
题目内容
2.钨在自然界主要以钨(+6价)酸盐的形式存在.黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成FeWO4、MnWO4.黑钨矿冶炼金属钨的流程如图1(已知:钨酸是一种难溶性强酸、对热不稳定).其中A、B、C都是钨的化合物.完成下列填空: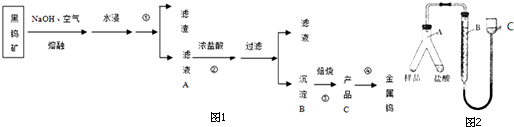
(1)上述从黑钨矿获得单质钨的过程中属于氧化还原反应的是④(填数字序号).
(2)操作①的名称为过滤,得到的滤液为钨酸的钠盐,写出反应②的化学方程式Na2WO4+2HCl→H2WO4↓+2NaCl.该过程中产品C为WO3,从产品C获得纯度较高的钨的另一反应原料应该为H2或CO.
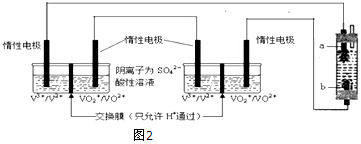
(3)若制得的钨中含有少量金属铁,为测定其中金属钨的含量(已知金属钨不溶于盐酸),甲同学用下列装置进行测定,相关实验步骤①加好称量好的样品和盐酸,记录B的液面位置;②检查气密性.③待A中不再有气体产生并恢复至室温后,记录B的液面位置;④将A中盐酸与样品混合;正确的操作顺序是②①④③填序号).
(4)若实验用样品的质量为a g,加入20mL盐酸与之充分反应后,测得排出水的体积为VL(标准状况下),测得的H2的体积应为VL,样品中的钨的质量分数的计算式为$\frac{22.4a-56V}{22.4a}×100%$.
(5)在读取图2C装置液面数据时,应先,再平视读数,若样品中含有不溶于酸,也不与酸反应的物质,则测得钨的质量分数将偏大(填“偏大”、“偏小”或“不受影响”).
分析 黑钨矿碱溶后,得到得到的滤液为钨酸的钠盐,加入浓盐酸,制取钨酸;钨酸(H2WO4)加热分解产生三氧化钨(WO3),判断C为三氧化钨(WO3);H2、CO等还原氧化钨生成钨;
(1)根据化合价升降分析氧化还原反应;
(2)操作①之后,分为滤渣和滤液,故为过滤;钨酸钠和浓盐酸反应生成钨酸(H2WO4)和氯化钠;钨酸(H2WO4)加热分解产生三氧化钨(WO3)和水,判断C为三氧化钨(WO3);H2、CO还原氧化钨生成钨;
(3)为测定其中金属钨的含量(已知金属钨不溶于盐酸),首先检验检查气密性;然后加入称量好的样品和盐酸;将A中盐酸与样品混合;待A中不再有气体产生并恢复至室温后,记录B的液面位置;
(4)用排水法收集H2,排出水的体积等于H2的体积;根据关系式:Fe~H2,样品中的钨的质量分数的计算式为1-$\frac{56V}{22.4a}$;
(5)读取图2C装置液面数据时,应先调整BC液面相平,再平视读数;若样品中含有不溶于酸,也不与酸反应的物质,把此杂质当做钨,则测得钨的质量分数将偏大.
解答 解:(1)①②属于复分解反应,③是分解反应;④为WO3制取W,化合价反应发生变化,属于氧化还原反应,故答案为:④;
(2)操作①之后,分为滤渣和滤液,故为过滤;钨酸钠和浓盐酸反应生成钨酸(H2WO4)和氯化钠;方程式为Na2WO4+2HCl→H2WO4↓+2NaCl;钨酸(H2WO4)酸性很弱,难溶于水,判断B为钨酸(H2WO4);钨酸(H2WO4)加热分解产生三氧化钨(WO3)和水,判断C为三氧化钨(WO3);H2、CO还原氧化钨生成钨;
故答案为:过滤;Na2WO4+2HCl→H2WO4↓+2NaCl;WO3;H2或CO;
(3)为测定其中金属钨的含量(已知金属钨不溶于盐酸),首先检验检查气密性;然后加入称量好的样品和盐酸;将A中盐酸与样品混合;待A中不再有气体产生并恢复至室温后,记录B的液面位置;
故答案为:②①④③;
(4)用排水法收集H2,测得排出水的体积为VL(标准状况下),则H2的体积也为VL;Fe~H2,Fe的物质的量为$\frac{V}{22.4×3}$mol,样品中的钨的质量分数的计算式为1-$\frac{56V}{22.4a}$=$\frac{22.4a-56V}{22.4a}×100%$;
故答案为:V;$\frac{22.4a-56V}{22.4a}×100%$;
(5)读取图2C装置液面数据时,应先调整BC液面相平,再平视读数;若样品中含有不溶于酸,也不与酸反应的物质,把此杂质当做钨,则测得钨的质量分数将偏大;
故答案为:调整BC液面相平;偏大.
点评 本题主要考查工业制备流程、金属的冶炼和化学计算,题目难度不大,本题注意判断A、B、C三种物质.

 走进文言文系列答案
走进文言文系列答案| A. | Ca(OH)2 | B. |  | C. | NaAlO2 | D. | Na2SiO3 |
| A. | 按系统命名法,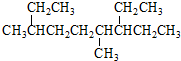 的名称为3,6-二甲基-7-乙基壬烷 的名称为3,6-二甲基-7-乙基壬烷 | |
| B. | 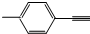 分子中所有原子共平面 分子中所有原子共平面 | |
| C. | 标准状况下,1 L辛烷完全燃烧生成CO28L | |
| D. | 1.0 mol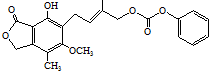 最多能与5.0 mol NaOH水溶液完全反应 最多能与5.0 mol NaOH水溶液完全反应 |
| A. | 用催化法处理尾气中的CO和NO:CO+NO$\frac{\underline{\;催化剂\;}}{\;}$C+NO2 | |
| B. | 少量SO2通入到Ba(OH)2溶液:SO2+Ba2++2OH-═BaSO3↓+H2O | |
| C. | NH4HCO3溶于过量的NaOH溶液中:HCO3+OH-═CO32-+H2O | |
| D. | 浓盐酸与二氧化锰供热:Mn2O+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O |
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
已知:CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H=-Q1 kJ•mol-1
HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l)△H=-Q2 kJ•mol-1
CH3COOH(aq)+NH3•H2O(aq)═CH3COONH4(aq)+H2O(l)△H=-Q3 kJ•mol-1
上述均是在溶液中进行的反应,Q1、Q2、Q3的关系正确的是( )
| A. | Q1=Q2=Q3=57.3 | B. | Q1>Q2>Q3>57.3 | C. | Q3<Q1<Q2=57.3 | D. | 无法确定 |
| A. | 简单离子的半径:r(A)<r(C)<r(D)<r(E) | |
| B. | 元素B的最简单气态氧化物的稳定性比C的强 | |
| C. | D2C2与A2C2的漂白原理相同 | |
| D. | 元素E的氧化物能溶于B或D的最高价氧化物对应的水化物中 |

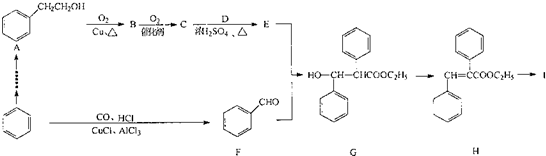
 .
. +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O:E+F--G的反应类型为加成反应.
+2H2O:E+F--G的反应类型为加成反应. +NaOH$\stackrel{△}{→}$C2H5OH+
+NaOH$\stackrel{△}{→}$C2H5OH+ .
.