题目内容
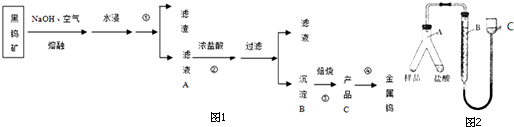
14.某工厂废弃的钒渣中主要含V2O5、VOSO4、K2SO4、SiO2等,现从该钒渣回收V2O5的工艺流程示意图如图1: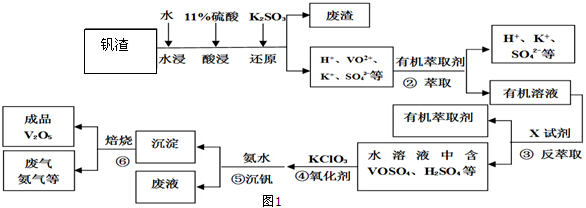
(已知:沉淀为(NH4)2V6O16\,全钒液流储能电池是利用不同价态离子对氧化还原反应来实现化学能和电能相互转化的装置,②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂).
R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层)
回答下列问题:
(1)(NH4)2V6O16中钒(V)的化合价为+5,①中产生的废渣的主要成分是SiO2.
(2)工艺中反萃取所用的X试剂为稀硫酸.
(3)为提高②中萃取效率,应采取的措施是加入碱(具体碱均可)中和硫酸使平衡正移、多次连续萃取.
(4)请完成④中的反应离子方程式:
1ClO${\;}_{3}^{-}$+6VO2++6H+=6VO3++1Cl-+3H2O
(5)成品V2O5可通过铝热反应来制取金属钒,写出该反应的化学方程式:10Al+3V2O5$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3.
(6)将两个全钒液流储能电池串联后作为电源,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,装置如图2:
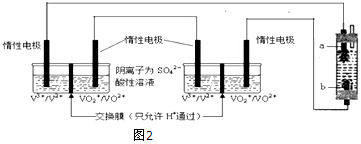
b为电解池的阳极,全钒液流储能电池正极的电极反应式为VO2++e-+2H+=VO2++H2O;
若通过消毒液发生器的电子为0.2mol,则消毒液发生器中理论上最多能产生14.9 gNaClO.
分析 钒渣中主要含V2O5、VOSO4、K2SO4、SiO2等,加硫酸,二氧化硅不溶解,加入还原剂K2SO3,V2O5被还原为VO2+离子,加入有机萃取剂,通过萃取②,把剩余的酸和有机层分开,通过反萃取③,把萃取剂和离子分开,加入氧化剂氯酸钾④,氯酸钾把VO2+氧化成VO3+,离子方程式为:ClO3-+6VO2++6H+→6VO3++Cl-+3H2O,调节pH得到含钒的沉淀,焙烧得到V2O5和氨气,有机萃取剂和氨气再循环利用.
(1)根据化合价代数和为0确定化合价;废钒催化剂的主要成分中二氧化硅不溶于酸;
(2)③中反萃取时加入的X试剂是抑制平衡正向进行;
(3)②中萃取时必须加入适量碱,分析平衡,R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层),加入的碱会和平衡中的氢离子反应促进平衡正向进行;提高②中萃取效率还可多次连续萃取;
(4)用化合价升降法配平方程式;
(5)铝热反应实质是置换反应,铝与五氧化二钒反应生成钒与氧化铝;
(6)在电解池的阴极上是阳离子得电子发生还原反应,在阳极上是阴离子发生失电子的氧化反应;原电池的正极发生还原反应;氯气可以和强碱反应生成氯化钠、次氯酸钠和水,根据得失电子守恒计算理论上最多能产生NaClO的质量.
解答 解:钒渣中主要含V2O5、VOSO4、K2SO4、SiO2等,加硫酸,二氧化硅不溶解,加入还原剂K2SO3,V2O5被还原为VO2+离子,加入有机萃取剂,通过萃取②,把剩余的酸和有机层分开,通过反萃取③,把萃取剂和离子分开,加入氧化剂氯酸钾④,氯酸钾把VO2+氧化成VO3+,离子方程式为:ClO3-+6VO2++6H+→6VO3++Cl-+3H2O,调节pH得到含钒的沉淀,焙烧得到V2O5和氨气,有机萃取剂和氨气再循环利用.
(1)氮的化合价为-3价,氢得化合价为+1价,氧的化合价为-2价,设(NH4)2V6O16中钒中V元素的化合价为x,根据化合价代数和为0得:[-3+1×(+4)]×2+6x+(-2)×16=0,解得x=+5,二氧化硅不和硫酸反应,故废渣中含二氧化硅,
故答案为:+5;SiO2;
(2)③中反萃取时加入的X试剂是抑制平衡正向进行,可以加入硫酸抑制平衡正向进行,故答案为:稀硫酸;
(3))②中萃取时必须加入适量碱,分析平衡,R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层),即Rn+(水层)+nHA(有机层)?RAn(有机层)+nH+(水层),加入碱(具体碱均可)中和硫酸使平衡正移,提高②中萃取效率还可采取多次连续萃取,
故答案为:加入碱(具体碱均可)中和硫酸使平衡正移、多次连续萃取;
(4)氯元素化合价从+5→-1,化合价降低6,钒化合价从+4→+5,化合价升高1,二者最小公倍数为6,把变价元素配平,初步配平为:ClO3-+6VO2++H+→6VO3++Cl-+H2O,根据氧原子守恒确定H2O前系数为3,氢离子前系数为6,故配平后为:ClO3-+6VO2++6H+=6VO3++Cl-+3H2O,
故答案为:1;6;6;6;1;Cl-;3;H2O;
(5)铝与五氧化二钒反应生成钒与氧化铝,反应反应方程式为:10Al+3V2O5$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3,故答案为:10Al+3V2O5$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3,
(6)将两个全钒液流储能电池串联后作为电源,用石墨作电极电解饱和氯化钠溶液,若通电时,为使生成的Cl2被完全吸收,制得有较强杀菌能力的消毒液,则电解池的下端产生的是氯气,上端产生的是氢气,电解池的阴极上是阳离子氢离子得电子发生得电子的还原反应,生成氢气,在阳极上是阴离子氯离子发生失电子的氧化反应,生成氯气,所以a是阴极,b是阳极生成Cl2,原电池的正极得到电子发生还原反应,全钒液流储能电池正极的电极反应式为:VO2++e-+2H+=VO2++H2O,制取消毒液所涉及反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,每生成1molNaClO转移1mol电子,若通过消毒液发生器的电子为0.2mol,理论上最多能产生NaClO的质量为0.2mol×74.5g/mol=14.9g,
故答案为:阳;VO2++e-+2H+=VO2++H2O;14.9.
点评 本题考查了流程分析判断、物质性质和实验设计的方法应用、题干信息分析判断能力,侧重考查物质的分离提纯、电解反应、电极产物的分析应用、工艺流程的理解,掌握基础是关键,题目难度中等.

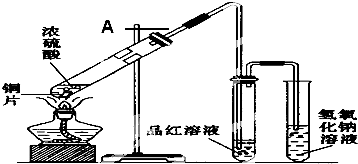
| A. | 在粗盐提纯中,当加热到蒸发皿中有较多固体析出,残留少量液体时,停止加热,用余热将液体蒸干 | |
| B. | 当振荡分液漏斗中的混合溶液时,须用一只手压住分液漏斗的玻璃塞,另一只手握住旋塞,将分液漏斗倒转过来,用力振荡 | |
| C. | 从加碘盐中获取碘单质的操作步骤为:溶解-萃取-分液-蒸馏 | |
| D. | 实验过程中若皮肤不慎沾上少量碱液,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗 |
(1)处理NOx的一种方法是利用氨气非催化还原法将NOx还原为N2.已知还原1molNO约放出451.7kJ的热量,同时生成气态水,则该反应的热化学方程式为4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H=-2710.2kJ•mol-1.
(2)用活性炭还原法处理氮氧化物,其反应为C(s)+2NO(g)?N2(g)+CO2(g).某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
②根据表中数据,计算T1℃时该反应的平衡常数为K=0.56(保留两位小数).
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率将不变 (填“增大”、“不变”或“减小”).
④下列各项能作为判断该反应达到平衡的是c、d (填序号字母);
a.容器内压强保持不变
b.2v正(NO)=v逆(N2)
c.容器内CO2的体积分数不变
d.混合气体的密度保持不变
⑤恒温恒容时,30min末改变某一条件,一段时间后反应重新达到平衡,则改变的条件可能是减小CO2的浓度.请在图1中画出30min至40min的变化曲线.
(3)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O═2H2SO4).已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
(4)全钒氧化还原液流电池是目前发展势头强劲的优秀绿色环保储能电池.该电池的原理可用如图2所示装置示意,溶液中c(H+)=2.0mol•L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色.则该电池充电时b极接直流电源的负极(填“正极”或“负极”),a极的电极反应式为VO2++H2O-e-═VO2++2H+.若假设溶液温度、体积没有变化,则放电时右槽溶液的pH将增大(填“增大”、“减小”或“不变”).

| A. |  用如图装置比较Na2CO3与NaHCO3的稳定性 | |
| B. |  用如图装置吸收NH3,并防止倒吸 | |
| C. |  用如图装置蒸干AlCl3饱和溶液制备AlCl3晶体 | |
| D. | 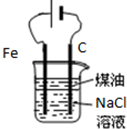 用如图装置制取Fe(OH)2沉淀 |
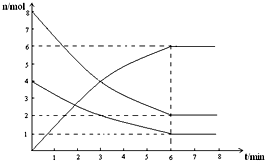 在673K、容积为2L的容器中发生下述反应,2SO2+O2?2SO3,开始时充入8molSO2和4molO2.测得各物质的物质的量随时间的变化曲线如图所示:
在673K、容积为2L的容器中发生下述反应,2SO2+O2?2SO3,开始时充入8molSO2和4molO2.测得各物质的物质的量随时间的变化曲线如图所示: