题目内容
11.以苯为原料合成高分子化合物I的路线如下: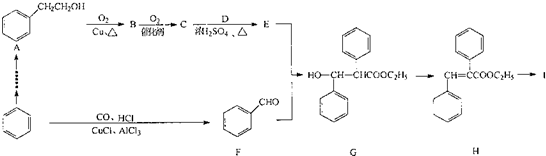
已知有机物的化学性质主要由官能团决定.请回答下列问题:
(1)G中所含有的官能团名称为羟基和酯基; I的结构简式为
 .
.(2)写出A-反应的化学方程式:2
 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O:E+F--G的反应类型为加成反应.
+2H2O:E+F--G的反应类型为加成反应.(3)写出H与NaOH溶液在加热条件下反应的化学方程式
 +NaOH$\stackrel{△}{→}$C2H5OH+
+NaOH$\stackrel{△}{→}$C2H5OH+ .
.
分析 据G、A和F的结构简式可知,A→B发生的是羟基氧化为醛基的反应,B为 ,B→C为醛基氧化为羧基的反应,C为苯乙酸,C与乙醇发生酯化反应生成E,E与F发生加成反应生成G,H中含有碳碳双键,能够发生加聚反应生成高分子化合物I,I为
,B→C为醛基氧化为羧基的反应,C为苯乙酸,C与乙醇发生酯化反应生成E,E与F发生加成反应生成G,H中含有碳碳双键,能够发生加聚反应生成高分子化合物I,I为 ,H中含有酯基,在NaOH溶液中能够水解,据此分析.
,H中含有酯基,在NaOH溶液中能够水解,据此分析.
解答 解:(1)据G的结构简式分析,G中含有的官能团有羟基和酯基;I的结构简式为: ,故答案为:羟基和酯基;
,故答案为:羟基和酯基; ;
;
(2)A→B发生的是羟基氧化为醛基的反应,反应方程式为2 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O,E与F发生加成反应生成G,
+2H2O,E与F发生加成反应生成G,
故答案为:2 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O;加成反应;
+2H2O;加成反应;
(3)H中含有酯基,在NaOH溶液中能够水解,反应方程式为 +NaOH$\stackrel{△}{→}$C2H5OH+
+NaOH$\stackrel{△}{→}$C2H5OH+ ,
,
故答案为: +NaOH$\stackrel{△}{→}$C2H5OH+
+NaOH$\stackrel{△}{→}$C2H5OH+ .
.
点评 本题考查有机物推断与合成,难度中等,注意掌握常见有机物的官能团的性质,注意对基础知识的理解掌握.

练习册系列答案
相关题目
6.下列说法不正确的是( )
| A. | 在粗盐提纯中,当加热到蒸发皿中有较多固体析出,残留少量液体时,停止加热,用余热将液体蒸干 | |
| B. | 当振荡分液漏斗中的混合溶液时,须用一只手压住分液漏斗的玻璃塞,另一只手握住旋塞,将分液漏斗倒转过来,用力振荡 | |
| C. | 从加碘盐中获取碘单质的操作步骤为:溶解-萃取-分液-蒸馏 | |
| D. | 实验过程中若皮肤不慎沾上少量碱液,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗 |
16.乙酸乙酯的同分异构体中,存在丙基的有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 6种 |
3.近年来,雾霾频发,重污染天气频现,控制大气污染迫在眉睫.二氧化硫(SO2)和氮氧化物(NOx)等是主要大气污染物,消除大气污染有多种方法.
(1)处理NOx的一种方法是利用氨气非催化还原法将NOx还原为N2.已知还原1molNO约放出451.7kJ的热量,同时生成气态水,则该反应的热化学方程式为4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H=-2710.2kJ•mol-1.
(2)用活性炭还原法处理氮氧化物,其反应为C(s)+2NO(g)?N2(g)+CO2(g).某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
①10min~20min以v(CO2)表示的平均反应速率为0.009mol•(L•min)-1.
②根据表中数据,计算T1℃时该反应的平衡常数为K=0.56(保留两位小数).
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率将不变 (填“增大”、“不变”或“减小”).
④下列各项能作为判断该反应达到平衡的是c、d (填序号字母);
a.容器内压强保持不变
b.2v正(NO)=v逆(N2)
c.容器内CO2的体积分数不变
d.混合气体的密度保持不变
⑤恒温恒容时,30min末改变某一条件,一段时间后反应重新达到平衡,则改变的条件可能是减小CO2的浓度.请在图1中画出30min至40min的变化曲线.
(3)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O═2H2SO4).已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
(4)全钒氧化还原液流电池是目前发展势头强劲的优秀绿色环保储能电池.该电池的原理可用如图2所示装置示意,溶液中c(H+)=2.0mol•L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色.则该电池充电时b极接直流电源的负极(填“正极”或“负极”),a极的电极反应式为VO2++H2O-e-═VO2++2H+.若假设溶液温度、体积没有变化,则放电时右槽溶液的pH将增大(填“增大”、“减小”或“不变”).

(1)处理NOx的一种方法是利用氨气非催化还原法将NOx还原为N2.已知还原1molNO约放出451.7kJ的热量,同时生成气态水,则该反应的热化学方程式为4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H=-2710.2kJ•mol-1.
(2)用活性炭还原法处理氮氧化物,其反应为C(s)+2NO(g)?N2(g)+CO2(g).某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
②根据表中数据,计算T1℃时该反应的平衡常数为K=0.56(保留两位小数).
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率将不变 (填“增大”、“不变”或“减小”).
④下列各项能作为判断该反应达到平衡的是c、d (填序号字母);
a.容器内压强保持不变
b.2v正(NO)=v逆(N2)
c.容器内CO2的体积分数不变
d.混合气体的密度保持不变
⑤恒温恒容时,30min末改变某一条件,一段时间后反应重新达到平衡,则改变的条件可能是减小CO2的浓度.请在图1中画出30min至40min的变化曲线.
(3)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O═2H2SO4).已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
(4)全钒氧化还原液流电池是目前发展势头强劲的优秀绿色环保储能电池.该电池的原理可用如图2所示装置示意,溶液中c(H+)=2.0mol•L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色.则该电池充电时b极接直流电源的负极(填“正极”或“负极”),a极的电极反应式为VO2++H2O-e-═VO2++2H+.若假设溶液温度、体积没有变化,则放电时右槽溶液的pH将增大(填“增大”、“减小”或“不变”).

20.化学与生产、生活密切相关.下列说法错误的是( )
| A. | 研发易降解的生物农药符合十八大报告中提到的生态文明建设 | |
| B. | 熟吃西红柿要比生吃维生素C的损失小 | |
| C. | 教育部发出禁令是因为吸烟也会产生多种有害有毒物质 | |
| D. | 大量焚烧田间秸秆会产生雾霾而影响空气质量 |