题目内容
7.某校课外活动小组同学设计实验,探究木炭与浓硫酸在加热条件下反应生成气体的成分.【实验探究】
(1)写出木炭与浓硫酸反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,若有0.2mol碳完全反应,则消耗H2S04的质量是39.2g,标况下产生SO2的体积为8.96L.
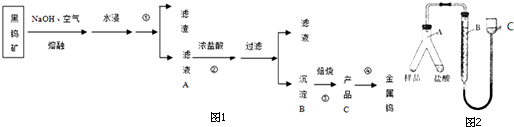
(2)图1中A装置中品红溶液颜色褪色(填“褪色”或“不褪色”),证明含有SO2(或二氧化硫)气体.装置B的作用是除去二氧化硫气体.
【实验讨论】
(3)有同学认为整个装置还存在缺陷,为使判断更准确,你认为应该在B、C装置之间连接图2中a 装置.

分析 (1)浓硫酸具有强的氧化性,与碳发生氧化还原反应,依据方程式计算消耗的浓硫酸的质量和产生二氧化硫的体积;
(2)二氧化硫具有漂白性,能够使品红溶液褪色,据此可以检验二氧化硫;酸性高锰酸钾溶液能够氧化二氧化硫从而将二氧化硫除去;
(3)用品红溶液检验二氧化硫是否除尽,避免干扰二氧化碳气体的检验.
解答 解:(1)木炭与浓硫酸反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,依据方程式可知1mol碳完全反应消耗浓硫酸物质的量为2mol,生成二氧化硫物质的量为2mol,所以若有0.2mol碳的完全反应,则消耗H2S04的0.4mol,质量为0.4mol×98g/mol=39.2g,生成二氧化硫的体积为0.4mol,标况下体积为22.4L/mol×0.4mol=8.96L,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;39.2;8.96;
(2)反应中有二氧化硫生成,则图1A装置中品红溶液颜色褪色,证明了混合气体中含有SO2;酸性高锰酸钾溶液具有强氧化性,能够将二氧化硫氧化成硫酸,从而除去二氧化硫,避免干扰二氧化碳的检验,
故答案为:褪色; SO2(或二氧化硫);除去二氧化硫气体;
(3)二氧化硫能够使品红溶液褪色,应该在B、C装置之间连接图2中的a-品红溶液,用于检验二氧化硫气体是否除尽,故答案为:a.
点评 本题考查了浓硫酸的性质、常见气体的检验,题目难度中等,明确浓硫酸与碳的反应原理及二氧化硫、二氧化碳的检验方法为解答关键,注意检验二氧化碳时,必须排除二氧化硫的干扰,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.盛满NO、NO2、O2混合气体的大试管倒置于盛水的水槽中,水面上升且充满试管,则NO、NO2、O2三种气体的体积比不可能是( )
| A. | 5:6:7 | B. | 1:1:1 | C. | 4:8:5 | D. | 8:4:7 |
11.下表为元素周期表中的一部分,列出10种元素在元素周期表中的位置.试用元素符号、离子符号或化学式回答下列问题.
(1)10种元素中,化学性质最不活泼的是Ar;(填元素符号)
(2)①③⑤三种元素最高价氧化物对应水化物中,碱性最强的是NaOH;(填化学式)
(3)元素⑦的氢化物(10电子分子)的化学式为H2O;该氢化物常温下和元素①的单质反应的化学方程式2Na+2H2O=2NaOH+H2↑;
(4)元素⑧的最高价氧化物对应水化物的化学式为H3PO4;元素⑨的最高正化合价为+7,氢化物的化学式为HCl;
(5)元素①和⑤的最高价氧化物对应的水化物相互反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑨ | ⑩ | ||
| 4 | ② | ④ |
(2)①③⑤三种元素最高价氧化物对应水化物中,碱性最强的是NaOH;(填化学式)
(3)元素⑦的氢化物(10电子分子)的化学式为H2O;该氢化物常温下和元素①的单质反应的化学方程式2Na+2H2O=2NaOH+H2↑;
(4)元素⑧的最高价氧化物对应水化物的化学式为H3PO4;元素⑨的最高正化合价为+7,氢化物的化学式为HCl;
(5)元素①和⑤的最高价氧化物对应的水化物相互反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
15.取a g某物质A,在氧气中完全燃烧,使燃烧产物跟足量过氧化钠反应,反应后固体的质量增加了b g.若b>a,则A为( )
| A. | H2 | B. | CO | C. | C12H22O11 | D. | C6H12O6 |
12.在下列化合物:①CH3-CH3 ②CH2=CH2 ③ ④
④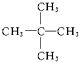 ⑤
⑤ ⑥CH3-CH═CH2 ⑦
⑥CH3-CH═CH2 ⑦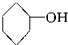 ⑧
⑧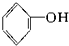 ⑨
⑨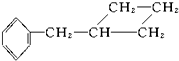 中,属于环状化合物的是③⑤⑦⑧⑨,属于脂环化合物的是⑤⑦,属于芳香化合物的是③⑧⑨,属于脂肪烃的是①②④⑥.
中,属于环状化合物的是③⑤⑦⑧⑨,属于脂环化合物的是⑤⑦,属于芳香化合物的是③⑧⑨,属于脂肪烃的是①②④⑥.
 ④
④ ⑤
⑤ ⑥CH3-CH═CH2 ⑦
⑥CH3-CH═CH2 ⑦ ⑧
⑧ ⑨
⑨ 中,属于环状化合物的是③⑤⑦⑧⑨,属于脂环化合物的是⑤⑦,属于芳香化合物的是③⑧⑨,属于脂肪烃的是①②④⑥.
中,属于环状化合物的是③⑤⑦⑧⑨,属于脂环化合物的是⑤⑦,属于芳香化合物的是③⑧⑨,属于脂肪烃的是①②④⑥.
16.乙酸乙酯的同分异构体中,存在丙基的有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 6种 |
17.偏二甲肼( )是运载火箭的主体燃料.C2H8N2物质中含碳碳单键的同分异构体共有( )
)是运载火箭的主体燃料.C2H8N2物质中含碳碳单键的同分异构体共有( )
 )是运载火箭的主体燃料.C2H8N2物质中含碳碳单键的同分异构体共有( )
)是运载火箭的主体燃料.C2H8N2物质中含碳碳单键的同分异构体共有( )| A. | 2种 | B. | 3 种 | C. | 4种 | D. | 5种 |