题目内容
14.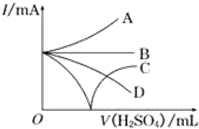 向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:①写出反应的离子方程式Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O.
②若缓缓加入稀H2SO4直至过量,整个过程中混合溶液中的导电能力(用电流强度I表示)可近似地用图中的曲线表示是C(填序号).
分析 (1)氢氧化钡与硫酸反应生成硫酸钡沉淀和水;
(2)加入稀硫酸直至过量,恰好反应时导电性为0,过量后离子浓度增大,导电性增强.
解答 解:(1)向Ba(OH)2溶液中逐滴加入稀硫酸,离子方程式为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故答案为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O;
(2)加入稀硫酸直至过量,恰好反应时导电性为0,过量后离子浓度增大,导电性增强,图中只有C符合,
故答案为:C.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,注意离子反应中保留化学式的物质及离子浓度与导电性关系,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.NaHSO4在水溶液中能电离出H+、Na+、和SO42-,下列对于NaHSO4的分类不正确的是( )
| A. | NaHSO4是盐 | B. | NaHSO4是一元酸 | C. | NaHSO4是钠盐 | D. | NaHSO4是酸式盐 |
9.下列离子方程式书写正确的是( )
| A. | 铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 碳酸钡溶于稀硝酸:BaCO3+2H+=Ba2++CO2↑+H2O | |
| C. | 实验室用大理石与盐酸反应制取二氧化碳:CO32-+2H+=CO2↑+H2O | |
| D. | 钠与水的反应:Na+H2O═Na++OH-+H2↑ |
6.下列铁的化合物中铁元素含量最高的是( )
| A. | FeO | B. | Fe2O3 | C. | Fe3O4 | D. | FeSO4 |
 .
.