题目内容
6.下列铁的化合物中铁元素含量最高的是( )| A. | FeO | B. | Fe2O3 | C. | Fe3O4 | D. | FeSO4 |
分析 Fe元素质量分数$\frac{Fe原子相对原子质量×原子个数}{相对分子质量}×100%$,将不同化学式转化为只含一个Fe原子的式子,分子相同,如果相对分子质量越小,则Fe元素含量越高.
解答 解:Fe元素质量分数$\frac{Fe原子相对原子质量×原子个数}{相对分子质量}×100%$,将不同化学式转化为只含一个Fe原子的式子,分子相同,如果相对分子质量越小,则Fe元素含量越高,Fe2O3、Fe3O4的化学式改写为$Fe{O}_{\frac{3}{2}}$、$Fe{O}_{\frac{4}{3}}$,根据FeO、$Fe{O}_{\frac{3}{2}}$、$Fe{O}_{\frac{4}{3}}$、FeSO4知,Fe原子个数相等,相对分子质量大小顺序是FeSO4、$Fe{O}_{\frac{3}{2}}$、$Fe{O}_{\frac{4}{3}}$、FeO,则铁含量从小到大顺序是FeSO4、$Fe{O}_{\frac{3}{2}}$、$Fe{O}_{\frac{4}{3}}$、FeO,故选A.
点评 本题考查元素质量分数计算,为高频考点,明确质量分数含义是解本题关键,注意化学式的灵活改变,从而正确解答,题目难度不大.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
17. 如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在C、A处充入均为10g的X、Y两种气体,且测得二者的密度相等.当隔板停止滑动时,下列说法一定正确的是( )
如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在C、A处充入均为10g的X、Y两种气体,且测得二者的密度相等.当隔板停止滑动时,下列说法一定正确的是( )
 如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在C、A处充入均为10g的X、Y两种气体,且测得二者的密度相等.当隔板停止滑动时,下列说法一定正确的是( )
如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在C、A处充入均为10g的X、Y两种气体,且测得二者的密度相等.当隔板停止滑动时,下列说法一定正确的是( )| A. | X、Y均为气体单质 | |
| B. | X、Y的相对分子质量相等 | |
| C. | n(H2)<n(X)=n(Y) | |
| D. | 隔板停止滑动时,A、B、C三部分体积相等 |
1.下列有关说法正确的是( )
| A. | H2O2→O2的变化过程中,必须要加入合适的氧化剂才能实现 | |
| B. | Al2O3+3C+N2═2AlN+3CO中,Al2O3是氧化剂 | |
| C. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑中MnO2是还原剂 | |
| D. | 有金属单质参加的反应中,金属单质一定作还原剂 |
6.NiSO4是一种重要的化工原料,大量用于电镀、触媒和纺织品染色等.某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍催化剂主要含有Ni,还含有Al、Fe的单质及氧化物,其他不溶杂质.
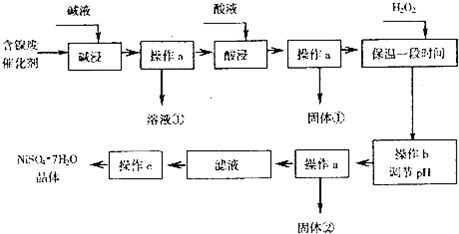
部分阳离子以氢氧化物形式完全沉淀时的pH如下:
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、漏斗、玻璃棒外还需要的主要仪器为蒸发皿.
(2)“碱浸”过程中发生的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑,Al2O3+2OH-═2AlO2-+H2O.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+.
(4)在40℃左右,用6%的H2O2能氧化Fe2+此外,还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀而把铁除去.图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾钠稳定存在的区域(已知25℃时,Fe(OH)3的Ksp=2.64×10-39).下列说法正确的是CD(选填序号).
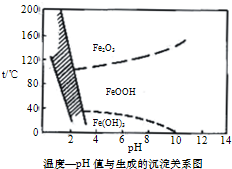
A.FeOOH中铁为+2价
B.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10-29
C.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O
D.工业生产中温度常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
(5)操作b调节pH的范围为3.2-7.1.
(6)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的.

部分阳离子以氢氧化物形式完全沉淀时的pH如下:
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、漏斗、玻璃棒外还需要的主要仪器为蒸发皿.
(2)“碱浸”过程中发生的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑,Al2O3+2OH-═2AlO2-+H2O.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+.
(4)在40℃左右,用6%的H2O2能氧化Fe2+此外,还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀而把铁除去.图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾钠稳定存在的区域(已知25℃时,Fe(OH)3的Ksp=2.64×10-39).下列说法正确的是CD(选填序号).

A.FeOOH中铁为+2价
B.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10-29
C.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O
D.工业生产中温度常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
(5)操作b调节pH的范围为3.2-7.1.
(6)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的.
3.氮化硅(Si3N4)是高温结构陶瓷,具有优良的性能,人们常常利用它来制造轴承、气轮机叶片、永久性模具等机械构件.设计的合成氮化硅工艺流程如下:

(1)①电弧炉中发生的主要反应是SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO↑.
②用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式
为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑,碳化硅又称金刚砂,其晶体结构与金刚石相似.
(2)在流化床反应的产物中,SiCl4大约占85%,还有Cl2等,有关物质的沸点数据如下表:
提纯SiCl4的主要工艺操作依次是沉降、蒸馏,其中温度最好控制在C(填序号).
A.略小于-34.1℃B.大于57.6℃C.略小于57.6℃D.-34.1℃
(3)①粉末状Si3N4遇水能生成一种有刺激性气味、常用做制冷剂的气体和一种难溶性的酸,该反应的方程式是Si3N4+9H2O=4NH3↑+3H2SiO3↓.
②该工艺流程中涉及的主要反应属于氧化还原反应的有2个.

(1)①电弧炉中发生的主要反应是SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO↑.
②用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式
为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑,碳化硅又称金刚砂,其晶体结构与金刚石相似.
(2)在流化床反应的产物中,SiCl4大约占85%,还有Cl2等,有关物质的沸点数据如下表:
| 物质 | Si | SiCl4 | Cl2 |
| 沸点/℃ | 2355 | 57.6 | -34.1 |
A.略小于-34.1℃B.大于57.6℃C.略小于57.6℃D.-34.1℃
(3)①粉末状Si3N4遇水能生成一种有刺激性气味、常用做制冷剂的气体和一种难溶性的酸,该反应的方程式是Si3N4+9H2O=4NH3↑+3H2SiO3↓.
②该工艺流程中涉及的主要反应属于氧化还原反应的有2个.
4.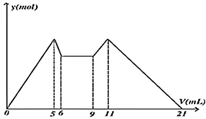 如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )
如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )
 如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )
如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )| A. | A是NaOH,B是盐酸,且C(NaOH):C(HCl)=2:1 | |
| B. | 原混合液中,C(Al3+):C(Mg2+):C(Cl-)=1:1:5 | |
| C. | A是NaOH,B是盐酸,且C(NaOH):C(HCl)=1:2 | |
| D. | 从6到9,相应离子反应式H++OH-=H2O |
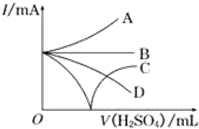 向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题: