题目内容
1.已知C2H2(g)+$\frac{5}{2}$O2(g)→2CO2(g)+H2O(l)△H=-1300kJ•mol-1,则下列说法正确的是( )| A. | 若生成NA个水蒸气分子反应热为△H0,则△H0<△H | |
| B. | 当有20NA个电子转移时,放出2600kJ 热量 | |
| C. | 当有4NA个碳氧共用电子对生成时,放出1300kJ热量 | |
| D. | 上述反应为吸热反应 |
分析 A.该反应为放热反应,放热热量越大,则焓变越小,若生成NA个水蒸气分子,即:生成1mol水蒸气,生成物中含有能量增大,则放热的热量减小,再结合焓变为负值进行判断;
B.反应消耗2.5mol氧气会转移10mol电子,放热1300kJ热量,据此计算出转移20NA个(2mol)电子放出的热量;
C.二氧化碳分子中含有两个碳氧双键,即含有4个碳氧共用电子对,则当有4NA个碳氧共用电子对生成时,生成了1mol二氧化碳,结合方程式计算放出热量;
D.该反应的焓变为负值,说明为放热反应.
解答 解:A.该反应为放热反应,放热热量越大,则焓变越小,若生成NA个水蒸气分子,即:生成1mol水蒸气,则放热的热量小于1300kJ,由于焓变为负值,则△H0>△H,故A错误;
B.根据反应可知,消耗2.5mol氧气会转移10mol电子,放热1300kJ热量,则当有20NA个电子转移时,放出2600kJ热量,故B正确;
C.二氧化碳分子中含有两个碳氧双键,即含有4个碳氧共用电子对,则当有4NA个碳氧共用电子对生成时,生成了1mol二氧化碳,放热的热量为:$\frac{1300kJ}{2}$=650kJ热量,故C错误;
D.该反应的焓变为负值,则该反应为放热反应,故D错误;
故选B.
点评 本题考查了热化学方程式,题目难度不大,明确热化学方程式的表示的意义及书写原则为解答关键,注意焓变数值大小与吸热、放热反应的关系,为易错点.

练习册系列答案
相关题目
9.下列关于有机物的说法不正确的是( )
| A. | 用饱和的Na2SO4溶液使鸡蛋清发生盐析,进而分离、提纯蛋白质 | |
| B. | 淀粉和纤维素的组成都可用(C6H10O5)n表示,它们互为同分异构体 | |
| C. | 苯酚与苯甲酸都能发生加成反应和取代反应 | |
| D. | 汽油和植物油都是碳氢化合物 |
16.下列说法中,正确的是( )
| A. | 离子化合物中一定不含共价键,共价化合物中一定不含离子键 | |
| B. | 分子间作用力越大,分子的热稳定性就越大 | |
| C. | 可能存在不含任何化学键的晶体 | |
| D. | 酸性氧化物形成的晶体一定分子晶体 |
6.NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4NA | |
| B. | 常温常压下,17g烃基含有的电子总数为9N | |
| C. | 标准状况下,11.2LCH2CI2中含有的共价键数目为2N. | |
| D. | CH2=CH2和CH2=CHCH3的混合气体28g,完全燃烧后生成的CO2分子数目为2.5N |
13.周期表中关于主族元素性质的下列叙述不正确的是( )
| A. | 主族序数等于原子最外层电子数 | |
| B. | 主族元素最高正化合价等于最外层电子数 | |
| C. | 第n主族元素其最高正化合价为+n价,最低负化合价绝对值为8-n(n≥4) | |
| D. | 第n主族元素其最高价氧化物分子式为R2On,氢化物分子式为RHn(n≥4) |
10.下列涉及有机物的性质或应用的说法不正确的是( )
| A. | 干馏煤可以得到甲烷、苯和氨等重要化工原料 | |
| B. | 用于奥运“祥云”火炬的丙烷是一种清洁燃料 | |
| C. | 用大米酿的酒在一定条件下密封保存,时间越长越香醇 | |
| D. | 氯乙烯、聚乙烯、苯乙烯都是不饱和烃 |
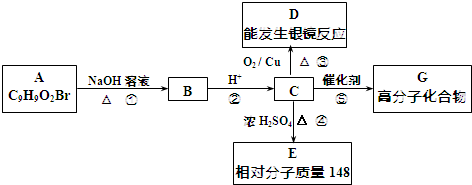
 .
.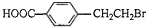 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$ +NaBr+H2O.反应⑤的化学方程式是
+NaBr+H2O.反应⑤的化学方程式是 .
.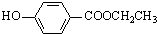 、
、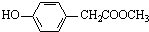 、还有4种.
、还有4种.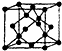 X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题: