题目内容
【题目】根据图中A~I均为中学化学中常见物质.其中A、B、 C、D为单质,通常情况下A为黄绿色气体,B为固体,C、D为无色气体:其余为化合物,其中常温下E是无色气体.其水溶液为强酸,G是具有磁性的物质,常温下I为液体。
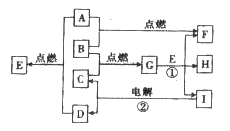
(1)写出下列物质的化学式:A________;F______;G_________。
(2)反应①的离子方程式为______________________________________。
(3)实验室要除去A气体中少量E,将混和气体通过盛有__________的洗气瓶洗气。
(4)F、 H可相互转化,写出一种F转化为H的化学方程式:__________________。
(5)请设计一组实验方案检验F中阳离子:_________________________________。
【答案】 Cl2 FeCl3 Fe3O4 Fe3O4+8H+==2Fe3++ Fe2++4H2O 饱和食盐水 Fe+2FeCl3==3FeCl2 取少量的F于试管中,滴加硫氰化钾溶液,若溶液变为红色则,F中的阳离子为Fe3+
【解析】通常情况下A为黄绿色气体,A是氯气。B为固体,G是具有磁性的物质,G是四氧化三铁,B是铁,C是氧气。常温下I为液体,I是水,电解水生成氢气和氧气,D是氢气。氢气在氯气中燃烧生成氯化氢,E是氯化氢。四氧化三铁和盐酸反应生成氯化铁、氯化亚铁和水。铁在氯气中燃烧生成氯化铁,F是氯化铁,所以H是氯化亚铁。则
(1)根据以上分析可知A是 Cl2,F是FeCl3,G是Fe3O4。(2)反应①的离子方程式为Fe3O4+8H+=2Fe3++ Fe2++4H2O。(3)氯化氢极易溶于水,实验室要除去氯气气体中少量氯化氢,将混和气体通过盛有饱和食盐水的洗气瓶洗气。(4)氯化铁与铁反应生成氯化亚铁,反应的化学方程式为Fe+2FeCl3=3FeCl2。(5)检验铁离子的实验方案为:取少量的F于试管中,滴加硫氰化钾溶液,若溶液变为红色则说明F中的阳离子为Fe3+。