题目内容
【题目】(1)水溶液中的离子平衡是中学化学的重要知识。
①25℃时,Na2CO3溶液呈碱性,原因是___________水解引起的(填“Na+”或“CO32-”);升高温度可以__________(填“促进”或“抑制”)Na2CO3的水解;
②常温下,pH=2的盐酸,该溶液中c( HCl )= _________________ mol/L;
(2)12g碳与适量水蒸气反应生成CO和H2,需吸收131.3kJ热量,此反应的热化学方程式为_____________________(填字母代号)。
A.C + H2O == CO + H2 ΔH= +131.3 kJ·mol-1
B. C(s)+ H2O(g) == CO(g) + H2(g) ΔH= +10.94 kJ·mol-1
C. C(s)+ H2O(g) == CO(g) + H2(g) ΔH= +131.3 kJ·mol-1
体积为1 L的容恒密闭容器中,充入1.00 mol CO2和3.00 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.00 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.00 kJ·mol-1
测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
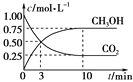
①从反应开始到平衡,二氧化碳的平均反应速率v(CO2)=______mol·(L·min)-1;
②该反应的平衡常数的表达式K= ___________________________;
③能说明该反应达到化学平衡状态的是__________(填字母代号);
A.c(CO2) = c(H2O) B.单位时间内消耗3mol H2,同时生成1mol CH3OH
C.容器内气体的压强不再变化
④下列措施中能使n(CH3OH)/n(CO2)增大的是________。
A.升高温度 B.将H2O(g)从体系中分离 C.再充入1.00 mol CO2
(4)下图是实验室电解精炼铜装置,
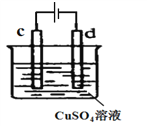
①d的电极材料为________________(填“粗铜”或“精铜”);
②c的电极反应方程式_______________________________。
【答案】 ![]() 促进 0.01 C 0.075
促进 0.01 C 0.075 ![]() C B 精铜 Cu- 2e- = Cu2+
C B 精铜 Cu- 2e- = Cu2+
【解析】试题分析:(1)①25℃时,Na2CO3水解呈碱性;水解吸热,升高温度水解平衡正向移动; ②盐酸是强酸,完全电离;
(2)反应吸收热量,焓变为正值,热化学方程式要标注反应物和生成物的状态。
(3)①结合图像数值,根据![]() 计算v(CO2);
计算v(CO2);
②该反应的平衡常数的定义书写表达式;
③根据化学平衡的定义分析达到化学平衡状态标志;
④根据平衡移动分析使n(CH3OH)/n(CO2)增大的措施。
(4)①精炼铜时粗铜做阳极、精铜做阴极;
②c与电源正极相连,c发生氧化反应。
解析:(1)①25℃时,Na2CO3是强碱弱酸盐,溶液呈碱性,原因是CO32-水解引起的;水解吸热,升高温度可以促进Na2CO3的水解,碱性增强;
②盐酸是强酸,完全电离,常温下,pH=2的盐酸, ![]() 0.01mol/L,所以溶液中c( HCl )=0.01 mol/L;
0.01mol/L,所以溶液中c( HCl )=0.01 mol/L;
(2)吸收热量,焓变为正值,热化学方程式要标注反应物和生成物的状态,反应的热化学方程式为C(s)+ H2O(g) == CO(g) + H2(g) ΔH = +131.3 kJ·mol-1;
(3)①从反应开始到平衡,二氧化碳的平均反应速率v(CO2)=![]() 0.075mol·(L·min)-1;
0.075mol·(L·min)-1;
②该反应的平衡常数的表达式K=  ;
;
③c(CO2) = c(H2O),都是正反应速率,不一定平衡,故A错误; B.单位时间内消耗3mol H2,同时生成1mol CH3OH,都是指正反应速率,不一定平衡,故B错误;
C.容器内气体的压强不再变化,说明气体物质的量不变,一定平衡,故C正确;
④反应放热,升高温度,平衡逆向移动,n(CH3OH)/n(CO2)减小,故A错误;将H2O(g)从体系中分离 ,平衡正向移动,n(CH3OH)/n(CO2)增大,故B正确;再充入1.00 mol CO2,CO2浓度增大,n(CH3OH)/n(CO2)减小,故C错误。
(4)①根据图示d是阴极、c是阳极,精炼铜时粗铜做阳极、精铜做阴极,所以d电极材料为精铜;
②c是阳极,铜失电子发生氧化反应,电极反应方程式为Cu- 2e- = Cu2+

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案【题目】食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于3.5 g/100 mL。用中和滴定的方法可以测定食醋中醋酸的浓度,某白醋的醋酸浓度测定过程如下图所示:

![]()
完成下列填空:
(1)稀释白醋时需要的仪器有烧杯、_____________________________。
(2)应选用__________作为指示剂。达到滴定终点时,指示剂从____色变为_____色。
(3)某同学一共进行了三次实验。以下是他设计的实验数据记录表,表格中A是______________,B是_______________。
实验次数 | 稀释后白醋 体积(mL) | 标准NaOH溶液 | ||
A | B | 消耗体积(mL) | ||
1 | 20.00 | 22.05 | ||
2 | 20.00 | 21.34 | ||
3 | 20.00 | 21.30 | ||
数据处理:消耗标准NaOH溶液的体积=______________mL。
若测得稀释后白醋的浓度0.0594 mol/L,则该食醋______(选填“符合”、“不符合”)国家标准。
标准NaOH溶液通过以下步骤准备:①配制500 mL浓度约为0.1 mol/L的NaOH溶液;
②用KHC8H4O4标准溶液准确测定该NaOH溶液的浓度。
(4)称量所需的NaOH固体置于大烧杯中,加入500 mL蒸馏水,搅拌溶解,该配制步骤____________
(填“可行”或“不可行”)。
(5)NaOH标准溶液的浓度需通过测定而不能直接配制的原因是__________________________。