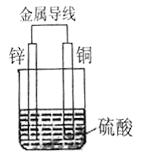
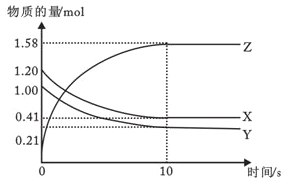
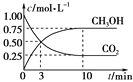
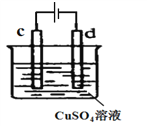
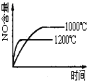
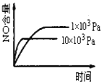
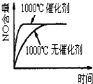
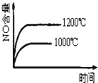
题目内容
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现__________色和__________色交替的现象。
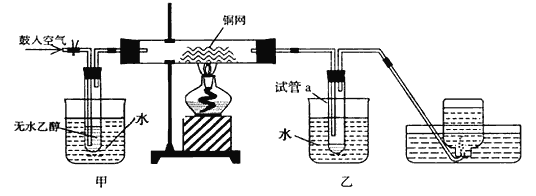
(2)甲和乙两个水浴作用不相同,其中甲中装的是热水,乙中装的是冷水。他们的作用依次为______________,________________。
(3)反应进行一段时间后,试管a中能 收集到若干种物质,其中一种液体能使紫色石蕊试纸显红色, 要除去该物质,可在混合液中加入_____________(填写字母)除去。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
【答案】 红色 黑色 使乙醇受热挥发 冷凝生成的反应物 C
【解析】(1)乙醇在铜做催化剂条件被氧气氧化成乙醛,反应中,铜丝变黑是因为发生反应:2Cu+O2![]() 2CuO,后来变红是因为发生反应:CH3CH2OH+CuO
2CuO,后来变红是因为发生反应:CH3CH2OH+CuO![]() CH3CHO+Cu+H2O,该反应是乙醇的催化氧化,此过程黑色的氧化铜变为红色的铜,铜在反应中做催化剂;(2)根据反应流程可知:在甲处用热水浴加热使乙醇挥发与空气中的氧气混合,有利于下一步反应;乙处作用为冷水浴,降低温度,使生成的乙醛冷凝成为液体,沉在试管的底部;(3)乙醛能被进一步氧化成乙酸,乙酸能使紫色石蕊试纸显红色,所以若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中含有乙酸;四个选择中,只有“C.碳酸氢钠”可以和乙酸反应,生成乙酸钠、水和二氧化碳,答案选C。
CH3CHO+Cu+H2O,该反应是乙醇的催化氧化,此过程黑色的氧化铜变为红色的铜,铜在反应中做催化剂;(2)根据反应流程可知:在甲处用热水浴加热使乙醇挥发与空气中的氧气混合,有利于下一步反应;乙处作用为冷水浴,降低温度,使生成的乙醛冷凝成为液体,沉在试管的底部;(3)乙醛能被进一步氧化成乙酸,乙酸能使紫色石蕊试纸显红色,所以若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中含有乙酸;四个选择中,只有“C.碳酸氢钠”可以和乙酸反应,生成乙酸钠、水和二氧化碳,答案选C。

【题目】二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃~140℃与硫反应,即可得S2Cl2粗品。
②有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
S | 112.8 | 444.6 | 略 |
S2Cl2 | -77 | 137 |
S2Cl2+Cl2 2SCl2 |
设计实验装置图如下:

(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见 。利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式: 。E中反应的化学方程式: 。
(3)C中的试剂是 。
(4)仪器B的名称是 。F的作用是 。
(5)如果在加热E时温度过高,对实验结果的影响是 。
(6)S2Cl2粗品中可能混有的杂质是(填写两种) ,为了提高S2Cl2的纯度,关键的操作是控制好温度和 。
【题目】草酸是植物(特别是草本植物)常具有的成分,具有广泛的用途。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,170℃以上分解。常温下它的电离常数K1=5.4×10-2,K2=5.4×10-5。回答下列问题:
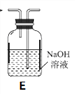
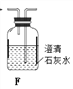
(1)拟用下列装置分解草酸制备少量纯净的CO,其合理的连接顺序为___________(填字母序号)。
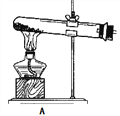

![]()

(2)相同温度条件下,分别用3支试管按下列要求完成实验:
试管 | A | B | C |
加入试剂 | 4mL 0.01mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.02mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.03mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 |
褪色时间 | 28秒 | 30秒 | 不褪色 |
写出试管B的离子方程式_____________________________________;上述实验能否说明“相同条件下,反应物浓度越大,反应速率越快”?____________(选填“能”或“不能”);简述你的理由:__________________________________。
(3)设计实验证明草酸为弱酸的方案及其现象均正确的有_____________(填序号)。
A.室温下,取0.010mol/L的H2C2O4溶液,测其pH=2;
B.室温下,取0.010mol/L的NaHC2O4溶液,测其pH >7;
C.室温下,取pH=a(a<3)的H2C2O4溶液稀释100倍后,测其pH< a+2;
D.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL;
(4)为测定某H2C2O4溶液的浓度,取20.00mL H2C2O4溶液于锥形瓶中,滴入2-3滴指示剂,用0.1000mol/L的NaOH溶液进行滴定,并进行3次平行实验,所用NaOH溶液体积分别为19.98mL、20.02mL和22.00mL。
①所用指示剂为_______________;滴定终点时的现象为_________________________;
②H2C2O4溶液物质的量浓度为_______________;
③下列操作会引起测定结果偏高的是__________(填序号)。
A. 滴定管在盛装NaOH溶液前未润洗
B. 滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C. 滴定前读数正确,滴定终点时俯视读数
D. 滴定前读数正确,滴定终点时仰视读数