题目内容
5.常温下用pH为3的某酸溶液分别与pH都为11的氨水、氢氧化钠溶液等体积混合得到a、b两种溶液,关于这两种溶液酸碱性的描述正确的是( )①b不能显碱性 ②a可能显酸性或碱性 ③a不可能显酸性 ④b可能显碱性或酸性.
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
分析 根据pH都为11的氨水、氢氧化钠溶液,氢氧化钠的浓度小,再讨论pH为3的某酸溶液,利用等体积混合反应后溶液中的溶质来分析溶液的酸碱性.
解答 解:①pH为3的某酸溶液,为强酸时与等体积pH为11的氢氧化钠恰好完全反应,生成强酸强碱盐,则溶液为中性;酸为弱酸时酸过量,则溶液一般为酸性,即b不可能显碱性,故①正确;
②某酸溶液为强酸时与等体积pH为11的氨水反应时氨水过量,则a可能显碱性;若为弱酸时恰好完全反应,生成弱酸弱碱盐,当弱酸酸根离子的水解小于弱碱中离子的水解,则a可能显酸性,故②正确;
③若为pH=3弱酸与等体积pH为11的氨水恰好完全反应时,生成弱酸弱碱盐,当弱酸酸根离子的水解沉淀小于弱碱中离子的水解沉淀,则a可能显酸性,故③错误;
④若pH为3的某酸溶液,为强酸时与等体积pH为11的氢氧化钠恰好完全反应,生成强酸强碱盐,则溶液为中性,若酸为pH=3弱酸与等体积pH为11的氢氧化钠溶液反应时酸过量,则溶液一般为酸性,即b不可能显碱性,故④错误;
故选A.
点评 本题考查溶液酸碱性的定性分析,明确pH为3的某酸可能为强酸或弱酸,明确盐与酸的溶液一般显酸性、盐与碱的溶液一般显碱性是解答的关键,此题应忽略盐中离子水解趋势与弱电解质电离趋势的比较来解答,题目难度中等.

练习册系列答案
相关题目
15. 据英国媒体报道,某品牌牙膏中含有的消毒剂三氯生,遇到含氯的自来水时能生成哥罗芳(三氯甲烷),哥罗芳能引发肝病甚至致癌.已知三氯生的结构简式如图所示,下列有关说法不正确的是( )
据英国媒体报道,某品牌牙膏中含有的消毒剂三氯生,遇到含氯的自来水时能生成哥罗芳(三氯甲烷),哥罗芳能引发肝病甚至致癌.已知三氯生的结构简式如图所示,下列有关说法不正确的是( )
 据英国媒体报道,某品牌牙膏中含有的消毒剂三氯生,遇到含氯的自来水时能生成哥罗芳(三氯甲烷),哥罗芳能引发肝病甚至致癌.已知三氯生的结构简式如图所示,下列有关说法不正确的是( )
据英国媒体报道,某品牌牙膏中含有的消毒剂三氯生,遇到含氯的自来水时能生成哥罗芳(三氯甲烷),哥罗芳能引发肝病甚至致癌.已知三氯生的结构简式如图所示,下列有关说法不正确的是( )| A. | 三氯生的分子式:C12H7Cl3O2 | B. | 哥罗芳属于烃类 | ||
| C. | 三氯生属于芳香族化合物 | D. | 哥罗芳不易溶于水 |
13.下列说法正确的是( )
| A. |  表示在其他条件不变时,2SO2 (g)+02 (g)?2S03 (g)转化关系中,纵坐标表示02的转化率 | |
| B. |  表示用0.1mol/L NaOH溶液分别滴定等浓度、等体积的盐酸和醋酸,其中实线为滴定醋酸的曲线 | |
| C. | 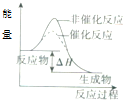 表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| D. | 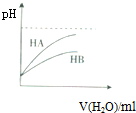 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则酸性HA<HB |
20.化学中常用图象直观地描述化学反应的进程或结果.下列图象描述正确的是( )
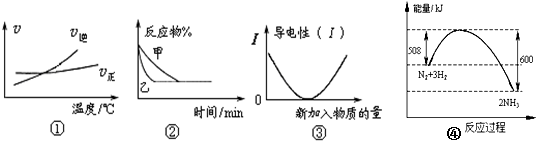

| A. | 根据图①可判断可逆反应 A2(g)+3B2(g)?2AB3(g) 的△H>0 | |
| B. | 图②表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 | |
| C. | 图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 | |
| D. | 图④是N2与H2合成氨的能量变化曲线,则1 mol N2和4 mol H2充分反应时放热一定小于92 kJ |
10.下列物质中的杂质(括号内为杂质)不能用加热法直接除去的是( )
| A. | Fe粉(硫粉) | B. | Na2CO3粉末(NaHCO3) | ||
| C. | NaCl(碘) | D. | KMnO4(MnO2) |
17.下列各组离子在强碱性溶液里能大量共存的是( )
| A. | Na+、K+、H+、SO42- | B. | Ba2+、Na+、NO3-、Cl- | ||
| C. | Na+、K+、S2-、CO32- | D. | Ba2+、Cu2+、NO3-、Cl- |
14.下列实验“操作和现象”与“结论”的对应关系正确的是( )
| 操作和现象 | 结论 | |
| A | 常温下将铝片放入浓硝酸中,无明显变化 | Al与浓硝酸不反应 |
| B | 向0.1mol•L-1 Na2CO3溶液中,滴加2滴酚酞,溶液显浅红色,微热,红色加深 | 盐类水解是吸热反应 |
| C | 向FeCl3溶液中加入足量的铜粉,充分反应后,静止,取上层清液滴加几滴KSCN溶液,溶液不变红色 | 氧化性:Cu 2+>Fe3+ |
| D | 向2mL 1mol•L-1 NaOH溶液中先加入3滴1mol•L-1 MgCl2溶液,再加入3滴1mol•L-1FeCl3溶液,沉淀由白色变成红褐色 | Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 |
| A. | A | B. | B | C. | C | D. | D |
15.常温时,浓度为0.01mol•L-1的稀盐酸用蒸馏水稀释108倍,则稀释后溶液的pH约为( )
| A. | 2 | B. | 7 | C. | 10 | D. | 12 |