题目内容
15.常温时,浓度为0.01mol•L-1的稀盐酸用蒸馏水稀释108倍,则稀释后溶液的pH约为( )| A. | 2 | B. | 7 | C. | 10 | D. | 12 |
分析 强酸的稀释规律:将pH=a的强酸加水稀释至原来的10b倍,则pH=a+b(当a+b>7时,让PH=7)来分析.
解答 解:根据强酸的稀释规律:将pH=a的强酸加水稀释至原来的10b倍,则pH=a+b(当a+b>7时,让PH=7)可知,0.01mol/L的盐酸溶液的PH=2,稀释至108倍后,由于2+8=10>7,但酸溶液再怎么稀释也不能变为碱性,故PH=7,故选B.
点评 本题考查了强酸稀释时pH的计算,应注意的是酸溶液稀释后至多变为中性,不能变为碱性,碱溶液稀释后也不可能变为酸性.

练习册系列答案
相关题目
5.常温下用pH为3的某酸溶液分别与pH都为11的氨水、氢氧化钠溶液等体积混合得到a、b两种溶液,关于这两种溶液酸碱性的描述正确的是( )
①b不能显碱性 ②a可能显酸性或碱性 ③a不可能显酸性 ④b可能显碱性或酸性.
①b不能显碱性 ②a可能显酸性或碱性 ③a不可能显酸性 ④b可能显碱性或酸性.
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
3.X、Y是浓度均为0.1mol/L的溶液中的某一种:①混有少量盐酸的MgSO4溶液 ②Al2(SO4)3溶液 ③明矾溶液 ④Ba(OH)2溶液 ⑤NaOH溶液.现向溶液X中逐滴加入溶液Y.得到的沉淀量与所加Y溶液的体积的关系的部分图象如图所示.则符合该图象的X、Y的组合共有( )

| A. | 4种 | B. | 5种 | C. | 6种 | D. | 8种 |
20.下列反应的离子方程式书写正确的是( )
| A. | 向NaOH溶液中通入少量CO2:OH-+CO2═HCO3- | |
| B. | 用氨水吸收少量SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| C. | Al(NO3)2溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+2H2O+4NH4+ | |
| D. | 向Fe2(SO4)3的酸性溶液中通入足量H2S:Fe3++H2S═Fe2++S↓+2H+ |
7.下列有关氧化剂还原反应的判断正确的是( )
| A. | 在反应Cl2+2NaOH═NaCl+NaClO+H2O中,Cl2是氧化剂,NaOH是还原剂 | |
| B. | 在反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,HCl是氧化剂,MnO2是还原剂 | |
| C. | 在反应NaH+H2O═NaOH+H2↑中,H2既是氧化物又是还原产物 | |
| D. | 在反应H2S+H2SO4═S↓+SO2↑+2H2O中SO2是氧化产物,S是还原产物 |
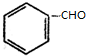 +H2(足量):
+H2(足量):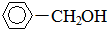 .
. +H2O2
+H2O2 +H2O
+H2O