题目内容
14.下列实验“操作和现象”与“结论”的对应关系正确的是( )| 操作和现象 | 结论 | |
| A | 常温下将铝片放入浓硝酸中,无明显变化 | Al与浓硝酸不反应 |
| B | 向0.1mol•L-1 Na2CO3溶液中,滴加2滴酚酞,溶液显浅红色,微热,红色加深 | 盐类水解是吸热反应 |
| C | 向FeCl3溶液中加入足量的铜粉,充分反应后,静止,取上层清液滴加几滴KSCN溶液,溶液不变红色 | 氧化性:Cu 2+>Fe3+ |
| D | 向2mL 1mol•L-1 NaOH溶液中先加入3滴1mol•L-1 MgCl2溶液,再加入3滴1mol•L-1FeCl3溶液,沉淀由白色变成红褐色 | Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.常温下,浓硝酸和Al发生钝化现象;
B.无色酚酞试液遇碱变红色,溶液碱性越强则该溶液红色越深;
C.自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物氧化性;
D.在反应过程中NaOH是过量的,所以NaOH和MgCl2溶液、FeCl3溶液都反应.
解答 解:A.常温下,浓硝酸和Al发生氧化还原反应生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,故A错误;
B.无色酚酞试液遇碱变红色,溶液碱性越强则该溶液红色越深,向0.1mol•L-1 Na2CO3溶液中,滴加2滴酚酞,溶液显浅红色,微热,红色加深,说明加热促进碳酸钠水解,则盐类水解是吸热反应,故B正确;
C.自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物氧化性,该反应方程式为2Fe3++Cu=2Fe2++Cu2+,该反应中Fe3+是氧化剂、Cu 2+是氧化产物,则氧化性Cu 2+<Fe3+,故C错误;
D.在反应过程中NaOH是过量的,所以NaOH和MgCl2溶液、FeCl3溶液都反应,所以不能根据沉淀颜色变化确定Mg(OH)2沉淀可以转化为Fe(OH)3沉淀,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及难溶物的转化、氧化性强弱比较、盐类水解、钝化等知识点,明确物质性质及反应原理是解本题关键,易错选项是D,注意:D选项中只有NaOH不足量时,再加入氯化铁产生红褐色沉淀能说明沉淀发生转化,题目难度中等.

练习册系列答案
相关题目
4.除去溶液中溶解的杂质,下列做法中不正确的是(括号内的物质为杂质)( )
| A. | NaCl溶液(Na2SO4)加入适量Ba(NO3)2溶液后,过滤 | |
| B. | NaNO3溶液(NaCl)加入适量AgNO3溶液后,过滤 | |
| C. | NaCl溶液(CaCl2)加入适量Na2CO3溶液后,过滤 | |
| D. | NaCl溶液(碘I2)加入四氯化碳后,分液 |
5.常温下用pH为3的某酸溶液分别与pH都为11的氨水、氢氧化钠溶液等体积混合得到a、b两种溶液,关于这两种溶液酸碱性的描述正确的是( )
①b不能显碱性 ②a可能显酸性或碱性 ③a不可能显酸性 ④b可能显碱性或酸性.
①b不能显碱性 ②a可能显酸性或碱性 ③a不可能显酸性 ④b可能显碱性或酸性.
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
2.下列有关试剂的保存方法正确的是( )
①NaOH固体保存在配有橡皮塞的细口瓶中;
②Na2CO3溶液通常保存在配有橡皮塞的细口瓶中;
③液溴通常用水封保存;
④锂保存在煤油中;
⑤浓硝酸通常保存在棕色细口瓶中.
①NaOH固体保存在配有橡皮塞的细口瓶中;
②Na2CO3溶液通常保存在配有橡皮塞的细口瓶中;
③液溴通常用水封保存;
④锂保存在煤油中;
⑤浓硝酸通常保存在棕色细口瓶中.
| A. | ①③⑤ | B. | ②③⑤ | C. | ②④⑤ | D. | ①③④ |
9.下列关于新制氯水的叙述不正确的是( )
| A. | 呈黄绿色,说明氯水中有Cl2 | |
| B. | 加入Na2CO3溶液产生气体,说明氯水有酸性 | |
| C. | 加入红色纸条,红色纸条褪色,说明氯水有漂白性 | |
| D. | 滴入石蕊溶液,溶液变成红色并保持不变,说明氯水有酸性 |
19.某一元醛发生银镜反应,生成金属银4.32g,等量该醛完全燃烧后,可生成水1.08g,则此醛可以是下列中的( )
| A. | 丙醛(CH3CH2CHO) | B. | 丙烯醛(CH2=CH-CHO) | ||
| C. | 丁醛(C3H7CHO) | D. | 丁烯醛(CH3-CH=CH-CHO) |
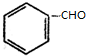 +H2(足量):
+H2(足量):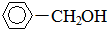 .
.