题目内容
在反应2SO2+O2 2SO3中,有a mol SO2和b mol O2参加反应,达到化学平衡状态时有c mol SO3生成,则SO2在平衡混合物中的体积分数为
2SO3中,有a mol SO2和b mol O2参加反应,达到化学平衡状态时有c mol SO3生成,则SO2在平衡混合物中的体积分数为
A.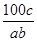 ×100% ×100% | B. ×100% ×100% |
C.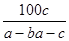 ×100% ×100% | D. % % |
D
解析试题分析:a mol SO2和b mol O2参加反应,达到化学平衡状态时有c mol SO3生成,则:
2SO2+O2 2SO3
2SO3
起始量(mol):a b 0
转化量(mol):c 0.5c c
平衡量(mol):a-c b-0.5c c
故φ(SO2)=(a-c)/[ (a-c)+(b-0.5c)+c]×100%=100(a-c)/(a+b-0.5c)%,答案选D。
考点:考查化学平衡的计算

为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究。
(1)①把含有较高浓度CO2的空气通入饱和K2CO3溶液。②在①的吸收液中通高温水蒸气得到高浓度的CO2气体。写出②中反应的化学方程式__________________________。
(2)如将CO2与H2以1:3的体积比混合。
①适当条件下合成某烃和水,该烃是 (填序号)。
| A.烷烃 | B.烯烃 | C.炔烃 | D.苯的同系物 |
 CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。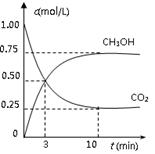
从反应开始到平衡,v(H2)= ;氢气的转化率= ;能使平衡体系中n(CH3OH)增大的措施有__________________________________________________。
(3)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。已知:
CH4 (g) +2O2(g)=CO2(g)+2H2O(l) △H1="―890.3" kJ/mol
H2(g) + 1/2O2(g)=H2O(l) △H2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是____________________。
(4)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表。
| 溶解度(S)/g | 溶度积(Ksp) | ||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 |
(说明:Ksp越小,表示该物质在水溶液中越易沉淀)
吸收CO2最合适的试剂是 (填“Ca(OH)2”或“Ba(OH)2”)溶液,实验时除需要测定工业废气的体积(折算成标准状况)外,还需要测定 。
恒温恒容的容器内,不可作为可逆反应I2(g)+H2(g) 2HI(g)达到平衡状态的标志的是
2HI(g)达到平衡状态的标志的是
| A.1 mol H—H键断裂,同时有2 mol H—I键断裂 | B.容器内气体的总压强不再变化 |
| C.H2的物质的量浓度不再变化 | D.混合气体的颜色不再变化 |
已知:N2(g)+3H2(g) 2NH3(g);△H="-92.4" kJ/mol,下列结论正确的是
2NH3(g);△H="-92.4" kJ/mol,下列结论正确的是
| A.在密闭容器中加入1 molN2(g)和3 molH2(g)充分反应放热92.4 kJ |
B.N2(g)+3H2(g) 2NH3(l);△H="-Q" kJ/mol,则Q>92.4 2NH3(l);△H="-Q" kJ/mol,则Q>92.4 |
| C.增大压强,平衡向右移动,平衡常数增大 |
| D.若一定条件下反应达到平衡,N2的转化率为20%,则H2的转化率一定为60% |
一定条件下密闭容器中发生如下反应:N2(g)+3H2(g) 2NH3(g),能说明该反应达到化学平衡状态的是 ( )
2NH3(g),能说明该反应达到化学平衡状态的是 ( )
| A.N2、H2、NH3的浓度相等 |
| B.N2、H2、NH3的浓度不再变化 |
| C.N2、H2、NH3在密闭容器中共存 |
| D.反应停止,正、逆反应速率都等于零 |
体积恒定的密闭容器中,反应2SO2(g)+O2(g) 2SO3(g) △H <0达平衡后,采用下列措施一段时间后,既能增大逆反应速率又能使平衡向正方向移动的是
2SO3(g) △H <0达平衡后,采用下列措施一段时间后,既能增大逆反应速率又能使平衡向正方向移动的是
| A.通入大量O2 | B.增大容器容积 | C.移去部分SO3 | D.降低体系温度 |
下列各表述与示意图一致的是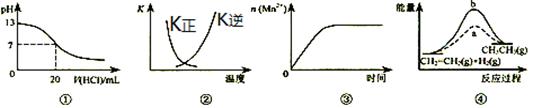
| A.图①表示25℃时,用0.1mol?L-1盐酸滴定20mL0.1mol?L-1NaOH溶液,溶液的pH随加入酸体积的变化 |
B.图②曲线表示反应2SO2(g)+O2(g) 2SO3(g);△H﹤0正、逆反应的平衡常数K随温度的变化 2SO3(g);△H﹤0正、逆反应的平衡常数K随温度的变化 |
| C.图③表示10mL0.01mol?L-1KMnO4酸性溶液与过量的0.1mol?L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化 |
| D.图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
一定条件下将0.1 mol N2和0.3 mol H2置于密闭容器中发生反应N2+3H2 2NH3。下列关于该反应的说法正确的是( )
2NH3。下列关于该反应的说法正确的是( )
| A.最终可生成0.2 mol NH3 | B.使用催化剂不影响反应速率 |
| C.增大压强反应速率减小 | D.升高温度反应速率增大 |
 A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是