题目内容
体积恒定的密闭容器中,反应2SO2(g)+O2(g) 2SO3(g) △H <0达平衡后,采用下列措施一段时间后,既能增大逆反应速率又能使平衡向正方向移动的是
2SO3(g) △H <0达平衡后,采用下列措施一段时间后,既能增大逆反应速率又能使平衡向正方向移动的是
| A.通入大量O2 | B.增大容器容积 | C.移去部分SO3 | D.降低体系温度 |
A
解析试题分析:A.通入大量O2,即增大反应物的浓度,无论是正反应还是逆反应的化学速率加快,平衡正向移动,正确;B.增大容器容积即减小压强,平衡逆向移动,逆反应的速率减小,错误;C.移去部分SO3,平衡正向移动,逆反应速率减小,错误;D.降低体系温度,化学反应速率减小,平衡正向移动,错误。
考点:考查外界条件对化学反应速率、化学平衡移动的影响的知识。

练习册系列答案
相关题目
金属铁用途广泛,高炉炼铁的总反应为:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g),请回答下列问题:
2Fe(s)+3CO2(g),请回答下列问题:
(1)一定温度下,在体积固定的密闭容器中发生上述反应,可以判断该反应已经达到平衡的是 。
| A.密闭容器中总压强不变 |
| B.密闭容器中混合气体的平均摩尔质量不变 |
| C.密闭容器中混合气体的密度不变 |
| D.c(CO)= c(CO2) |
(2)一定温度下,上述反应的化学平衡常数为3.0,该温度下将4molCO、2molFe2O3、6molCO2、5molFe加入容积为2L的密闭容器中,此时反应将向 反应方向进行(填“正”或“逆”或“处于平衡状态”);反应达平衡后,若升高温度,CO与CO2的体积比增大,则正反应为 反应(填“吸热”或“放热”) 。
(3)已知:3Fe2O3(s)+CO(g)
 2Fe3O4(s)+CO2(g) △H="–47" kJ/mol
2Fe3O4(s)+CO2(g) △H="–47" kJ/molFe3O4(s)+CO(g)
 3FeO(s)+CO2(g) △H=" +19" kJ/mol
3FeO(s)+CO2(g) △H=" +19" kJ/molFeO(s)+CO(g)
 Fe(s)+CO2(g) △H="–11" kJ/mol
Fe(s)+CO2(g) △H="–11" kJ/mol则Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g)的△H= 。
2Fe(s)+3CO2(g)的△H= 。(4)上述总反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下表:
| 温度 | 250℃ ~ 600℃ ~ 1000℃ ~ 2000℃ |
| 主要成分 | Fe2O3 Fe3O4 FeO Fe |
800℃时固体物质的主要成分为 ,该温度下若测得固体混合物中m(Fe)︰m(O)=105︰32,则Fe3O4被CO还原为FeO的百分率为 (设其它固体杂质中不含Fe、O元素)。
在反应2SO2+O2 2SO3中,有a mol SO2和b mol O2参加反应,达到化学平衡状态时有c mol SO3生成,则SO2在平衡混合物中的体积分数为
2SO3中,有a mol SO2和b mol O2参加反应,达到化学平衡状态时有c mol SO3生成,则SO2在平衡混合物中的体积分数为
A.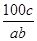 ×100% ×100% | B.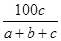 ×100% ×100% |
C.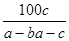 ×100% ×100% | D.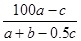 % % |
体积相同的甲、乙两个容器中,分别充入等物质的量的SO2和O2,在相同温度下发生反应:2SO2(g)+O2(g) 2SO3(g),并达到平衡,在此过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
2SO3(g),并达到平衡,在此过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
| A.等于p% | B.大于p% | C.小于p% | D.无法比较 |
在溶液中,CaCl2+CO2+H2O=CaCO3↓+2HCl在任何条件下都不能发生,原因是该反应的( )
| A.△H >0ΔS>0 | B.△H<0ΔS<0 | C.△H<0 ΔS>0 | D.△H >0ΔS<0 |
下列平衡常数中,表示的正反应程度最大的是
A.K=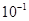 | B.K=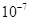 | C.K=1 | D.K=1010 |
下列关于化学反应限度的说法正确的是( )
| A.当一个可逆反应达到平衡状态时,这就是这个反应所能达到的限度 |
| B.当一个可逆反应进行到平衡状态时,这个反应的正向反应速率和逆向反应速率相等 |
| C.平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变 |
| D.化学反应的限度不可以通过改变条件而改变 |
在一定温度下的定容容器中,反应:A(s)+2B(g) C(g) +D(g)。下列不能表明反应
C(g) +D(g)。下列不能表明反应
达到平衡状态的是( )。
| A.气体的压强不变 | B.气体平均相对分子质量不变 |
| C.气体的密度不变 | D.B物质的量浓度不变 |
