题目内容
下列各表述与示意图一致的是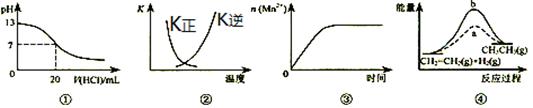
| A.图①表示25℃时,用0.1mol?L-1盐酸滴定20mL0.1mol?L-1NaOH溶液,溶液的pH随加入酸体积的变化 |
B.图②曲线表示反应2SO2(g)+O2(g) 2SO3(g);△H﹤0正、逆反应的平衡常数K随温度的变化 2SO3(g);△H﹤0正、逆反应的平衡常数K随温度的变化 |
| C.图③表示10mL0.01mol?L-1KMnO4酸性溶液与过量的0.1mol?L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化 |
| D.图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
B
解析试题分析:A.用0.1mol?L-1盐酸滴定20mL0.1mol?L-1NaOH溶液,当达到滴定终点时溶液的pH会有大的突越,错误;B.反应2SO2(g)+O2(g) 2SO3(g);△H﹤0的正反应是放热反应,则逆反应是吸热反应,当升高温度时,平衡逆向移动,正反应平衡常数减小;逆反应的平衡常数K增大,二者互为倒数,正确;C.图③表示用10mL0.01mol?L-1KMnO4酸性溶液滴定过量的0.1mol?L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化,错误;D.由于该反应是放热反应,反应物的能量比生成物的能量高,所以图④中a、b曲线不能表示反应CH2=CH2(g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化,错误。
2SO3(g);△H﹤0的正反应是放热反应,则逆反应是吸热反应,当升高温度时,平衡逆向移动,正反应平衡常数减小;逆反应的平衡常数K增大,二者互为倒数,正确;C.图③表示用10mL0.01mol?L-1KMnO4酸性溶液滴定过量的0.1mol?L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化,错误;D.由于该反应是放热反应,反应物的能量比生成物的能量高,所以图④中a、b曲线不能表示反应CH2=CH2(g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化,错误。
考点:考查图像法在表示酸碱中和滴定、反应中的能量变化、微粒的浓度、平衡常数与温度关系的知识。

练习册系列答案
相关题目
在反应2SO2+O2 2SO3中,有a mol SO2和b mol O2参加反应,达到化学平衡状态时有c mol SO3生成,则SO2在平衡混合物中的体积分数为
2SO3中,有a mol SO2和b mol O2参加反应,达到化学平衡状态时有c mol SO3生成,则SO2在平衡混合物中的体积分数为
A.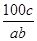 ×100% ×100% | B.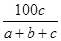 ×100% ×100% |
C.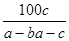 ×100% ×100% | D.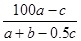 % % |
在溶液中,CaCl2+CO2+H2O=CaCO3↓+2HCl在任何条件下都不能发生,原因是该反应的( )
| A.△H >0ΔS>0 | B.△H<0ΔS<0 | C.△H<0 ΔS>0 | D.△H >0ΔS<0 |
下列平衡常数中,表示的正反应程度最大的是
A.K=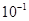 | B.K=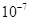 | C.K=1 | D.K=1010 |
已知有反应:I2(g)+H2(g)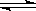 2HI(g)△H<0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中x的值,则y随x变化趋势合理的是
2HI(g)△H<0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中x的值,则y随x变化趋势合理的是
| 选项 | X | Y |  |
| A | 温度 | 容器内混合气体的密度 | |
| B | I2的物质的量 | H2的转化率 | |
| C | H2的浓度 | 平衡常数K | |
| D | 加入Ar的物质的量 | 逆反应速率 |
下列关于化学反应限度的说法正确的是( )
| A.当一个可逆反应达到平衡状态时,这就是这个反应所能达到的限度 |
| B.当一个可逆反应进行到平衡状态时,这个反应的正向反应速率和逆向反应速率相等 |
| C.平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变 |
| D.化学反应的限度不可以通过改变条件而改变 |
已知某反应aA(g)+bB(g)?==?cC(g)的各物质浓度数据如下:
| | A | B | C |
| 起始浓度(mol·L-1) | 3.0 | 1.0 | 0 |
| 2 s末浓度(mol·L-1) | 1.8 | 0.6 | 0.8 |
A.9∶3∶4 B.3∶1∶2 C.2∶1∶3 D.3∶2∶1
 2C(g),该反应进行到一定限度后达到化学平衡的标志是
2C(g),该反应进行到一定限度后达到化学平衡的标志是