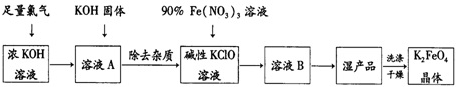
题目内容
10.废定影液中含有Na+、[Ag(S2O3)2]3-、Br-等离子.某研究性学习小组拟通过下列实验程序,对废定影液进行实验处理,回收其中的银和溴.已知:4H++2[Ag(S2O3)2]3-=Ag2S↓+3S↓+3SO2↑+SO42-+2H2O
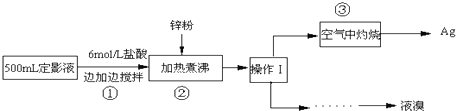
(1)加入锌粉的目的是将溶液中的少量溴化银还原出来,该反应的化学方程式为:2AgBr+Zn=2Ag+ZnBr2.
(2)从绿色化学的要求看,该研究性学习小组所拟定的回收银的实验流程中,存在的严重缺陷为在空气中灼烧时产生的SO2有毒,污染空气.
(3)请你帮助该研究性学习小组设计回收液溴的主要实验步骤:
①向滤液中通入适量氯气;②在混合物中加入四氯化碳充分振荡后分液;③蒸馏,收集所得馏分.
分析 定影液中加入盐酸,发生反应4H++2[Ag(S2O3)2]3-=Ag2S↓+3S↓+3SO2↑+SO42-+2H2O,将溶液加热煮沸,然后向溶液中加入锌粉,目的是将AgBr中的Ag还原出来,从而得到Ag单质,然后采用过滤方法得到沉淀和滤液,将沉淀在空气中灼烧得到Ag单质,向滤液中通入过量氯气,然后采用萃取、蒸馏的方法获取液溴,
(1)Zn和少量AgBr发生置换反应生成Ag;
(2)灼烧Ag2S时会产生有毒气体二氧化硫,从而污染环境;
(3)向滤液中通入适量氯气,氯气和溴离子发生置换反应生成溴,然后采用萃取方法获取溴的四氯化碳溶液,最后采用蒸馏方法得到溴.
解答 解:定影液中加入盐酸,发生反应4H++2[Ag(S2O3)2]3-=Ag2S↓+3S↓+3SO2↑+SO42-+2H2O,将溶液加热煮沸,然后向溶液中加入锌粉,目的是将AgBr中的Ag还原出来,从而得到Ag单质,然后采用过滤方法得到沉淀和滤液,将沉淀在空气中灼烧得到Ag单质,向滤液中通入过量氯气,然后采用萃取、蒸馏的方法获取液溴,
(1)Zn和少量AgBr发生置换反应生成Ag,反应方程式为2AgBr+Zn=2Ag+ZnBr2,
故答案为:2AgBr+Zn=2Ag+ZnBr2;
(2)灼烧Ag2S时会产生有毒气体二氧化硫,从而污染环境,所以存在严重缺陷,
故答案为:在空气中灼烧时产生的SO2有毒,污染空气;
(3)向滤液中通入适量氯气,氯气和溴离子发生置换反应生成溴,然后采用萃取方法将溴萃取到四氯化碳溶液中,从而获取溴的四氯化碳溶液,最后根据沸点不同采用蒸馏方法得到溴,所以操作步骤为:②在混合物中加入四氯化碳充分振荡后分液、③蒸馏,收集所得馏分,
故答案为:②在混合物中加入四氯化碳充分振荡后分液;③蒸馏,收集所得馏分.
点评 本题考查混合物的分离和提纯,为高频考点,侧重考查物质的性质、基本操作方法,明确实验原理及物质性质是解本题关键,会根据物质性质确定分离方法,题目难度不大.

| A. | 硫粉在过量的纯氧中燃烧可以生成SO3 | |
| B. | 可以用澄清石灰水鉴别SO2和CO2 | |
| C. | SO2能使酸性KMnO4水溶液褪色,是因为SO2有漂白性 | |
| D. | 铁粉与过量硫粉反应生成硫化亚铁 |
| A. | X、Y、Z的物质的量之比为1:2:2 | |
| B. | X、Y、Z的浓度不再发生变化 | |
| C. | 容器中的压强不再发生变化 | |
| D. | 单位时间内生成n mol Z,同时生成2n mol Y |
| A. | 硝酸浓度越大,反应消耗的硝酸越少 | |
| B. | 硝酸浓度越大,产生的气体越少 | |
| C. | 硝酸浓度不同,生成Cu(NO3)2的物质的量不同 | |
| D. | 两者用排水法收集到气体体积相等 |
| A. | 纳米材料是指一种称为“纳米”的新物质制成的材料 | |
| B. | 绿色食品是指不含任何化学物质的食品 | |
| C. | 光导纤维是以二氧化硅为主要原料制成的 | |
| D. | 合成纤维的主要原料是石油、天然气、煤 |
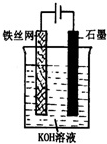
 实验室用FeSO4溶液和NaOH溶液反应制取Fe(OH)2,却很难看到稳定的白色沉淀.有同学设计了一种新的实验方法,能清楚看到生成白色沉淀及白色沉淀转化成红褐色沉淀的现象.请完成以下空白:
实验室用FeSO4溶液和NaOH溶液反应制取Fe(OH)2,却很难看到稳定的白色沉淀.有同学设计了一种新的实验方法,能清楚看到生成白色沉淀及白色沉淀转化成红褐色沉淀的现象.请完成以下空白: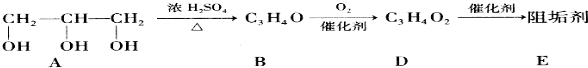
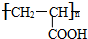 ;其反应类型为加聚反应;
;其反应类型为加聚反应;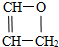 .
.