题目内容
20.下列说法正确的是( )| A. | 硫粉在过量的纯氧中燃烧可以生成SO3 | |
| B. | 可以用澄清石灰水鉴别SO2和CO2 | |
| C. | SO2能使酸性KMnO4水溶液褪色,是因为SO2有漂白性 | |
| D. | 铁粉与过量硫粉反应生成硫化亚铁 |
分析 A.硫与氧气反应只生成二氧化硫;
B.二氧化硫和二氧化碳都能使澄清石灰水变浑浊,气体过量时沉淀都溶解;
C.二氧化硫与酸性高锰酸钾发生氧化还原反应;
D.S具有弱氧化性,与铁反应生成硫化亚铁.
解答 解:A.硫与氧气反应只生成二氧化硫,二氧化硫与氧气在催化剂条件下生成SO3,故A错误;
B.二氧化硫和二氧化碳都能使澄清石灰水变浑浊,气体过量时沉淀都溶解,所以不能用澄清石灰水鉴别二氧化碳和二氧化硫,可以用品红溶液检验二者,故B错误;
C.二氧化硫与酸性高锰酸钾发生氧化还原反应,反应中二氧化硫表现还原性,故C错误;
D.S具有弱氧化性,无论硫是否过量,与铁反应生成硫化亚铁,故D正确.
故选D.
点评 本题综合考查元素化合物知识,为高考常见题型,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
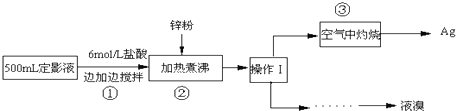
10.硼镁泥是一种工业废料,主要成分是MgO,还有CaO、MnO、Fe2O、FeO、Al2O3,、SiO2等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业.从硼镁泥中制取MgSO4•7H2O的工艺流程如下:

已知:NaClO与Mn2+反应产生MnO2沉淀.
(1)实验中需用1.00mol•L-1的硫酸80.0ml.若用98%的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有烧杯、100mL容量瓶.
(2)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还有MnO2、SiO2.
(3)“操作I”的主要操作为蒸发浓缩、冷却结晶、过滤洗涤.
(4)写出加入NaClO时,溶液中氧化还原反应的离子方程式Mn2++ClO-+H2O=MnO2↓+2H++Cl-、2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(5)已知:溶液的pH>3时,铝元素有多种存在形态,如A13+、[Al(OH)]2+、[Al(OH)2]+等,各形态之间可相互转化,写出该溶液中[Al(OH)]2+转化为[Al(OH)2]+的离子方程式[Al(OH)]2++H+=[Al(OH)]++H2O.
(6)某同学为探究Ag+和Fe2+反应,按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.电子由石墨经导线流向银.放置一段时间后,向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小-回到零点-逆向偏移.则电压表指针逆向偏移后,银为负极(填“正”或“负”).由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.


已知:NaClO与Mn2+反应产生MnO2沉淀.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
(2)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还有MnO2、SiO2.
(3)“操作I”的主要操作为蒸发浓缩、冷却结晶、过滤洗涤.
(4)写出加入NaClO时,溶液中氧化还原反应的离子方程式Mn2++ClO-+H2O=MnO2↓+2H++Cl-、2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(5)已知:溶液的pH>3时,铝元素有多种存在形态,如A13+、[Al(OH)]2+、[Al(OH)2]+等,各形态之间可相互转化,写出该溶液中[Al(OH)]2+转化为[Al(OH)2]+的离子方程式[Al(OH)]2++H+=[Al(OH)]++H2O.
(6)某同学为探究Ag+和Fe2+反应,按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.电子由石墨经导线流向银.放置一段时间后,向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小-回到零点-逆向偏移.则电压表指针逆向偏移后,银为负极(填“正”或“负”).由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.

11.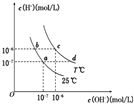 在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )
 在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )| A. | a点对应的溶液中大量存在:CO32-、Na+、Cl-、SO42- | |
| B. | b点对应的溶液中大量存在:Fe2+、Ba2+、K+、NO3- | |
| C. | c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Al3+ | |
| D. | d点对应的溶液中大量存在:Na+、K+、ClO-、Cl- |
8.银耳本身为淡黄色,福建省出产一种雪耳,颜色洁白如雪.其制作过程如下:将银耳堆放在密封状况良好的塑料棚内,在棚的一端置一口锅,锅内放硫磺,加热使硫磺熔化并燃烧,两天左右,雪耳就制成了.这种雪耳是对人体有害的.制作雪耳利用了( )
| A. | 硫的还原性 | B. | 硫的氧化性 | ||
| C. | 二氧化硫的还原性 | D. | 二氧化硫的漂白性 |
15.下列实验能获得成功的是( )
| A. | 向乙酸乙酯中加入足量的30%NaOH溶液,在加热的条件下观察酯层的消失 | |
| B. | 乙醇与浓硫酸混合,加热至140℃制取乙烯 | |
| C. | 向2mL的甲苯中加入3滴KMnO4酸性溶液,用力振荡,观察溶液颜色褪去 | |
| D. | 1 mol•L-1CuSO4溶液2 mL和0.5mol•L-1NaOH溶液2mL混合后加入40%的乙醛溶液0.5mL,加热煮沸观察砖红色沉淀的生成 |
5.下列说法,可以说明在固定容积的密闭容器中,反应N2(g)+3H2(g)?2NH3(g)已达到化学平衡状态的是( )
| A. | 1个N≡N键断裂的同时,有2个N-H键断裂 | |
| B. | 3V正(N2)=V逆(H2) | |
| C. | 容器内混合气体的密度不再变化 | |
| D. | 容器内N2、H2、NH3的浓度比为1:3:2 |
12.2012年1月16日在阿联酋首都阿布扎比举行的“2012年世界未来能源峰会”上,联合国秘书长潘基文启动联合国“人人享有可持续能源国际年”.下列不能体现“可持续”理念的是( )
| A. | 应用高效洁净的能源转换技术,推广使用节能环保材料 | |
| B. | 大力发展火力发电,解决电力紧张问题 | |
| C. | 研发以高纯硅为核心材料的光伏发电技术 | |
| D. | 大力开发新能源,如核能、太阳能、风能等,减少化石能源的使用 |
9.已知有如下反应:①2BrO3-+Cl2═Br2+2ClO3-,②2FeCl2+Cl2═2FeCl3 ③ClO3-+5Cl-+6H+═3Cl2+3H2O,④2FeCl3+2KI═2FeCl2+2KCl+I2,下列各微粒氧化能力由强到弱的顺序正确的是( )
| A. | ClO3->BrO3->Cl2>Fe3+>I2 | B. | BrO3->Cl 2>ClO3->I2>Fe3+ | ||
| C. | BrO3->ClO3->Cl2>Fe3+>I2 | D. | BrO3->ClO3->Fe3+>Cl2>I2 |