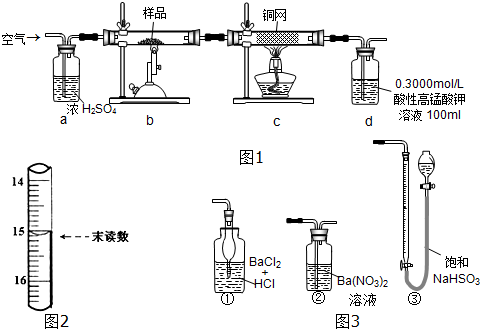
题目内容
5.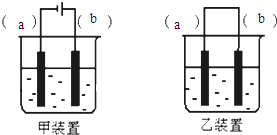 实验室用FeSO4溶液和NaOH溶液反应制取Fe(OH)2,却很难看到稳定的白色沉淀.有同学设计了一种新的实验方法,能清楚看到生成白色沉淀及白色沉淀转化成红褐色沉淀的现象.请完成以下空白:
实验室用FeSO4溶液和NaOH溶液反应制取Fe(OH)2,却很难看到稳定的白色沉淀.有同学设计了一种新的实验方法,能清楚看到生成白色沉淀及白色沉淀转化成红褐色沉淀的现象.请完成以下空白:(1)取一定体积的0.1mol.L-1NaOH溶液放于烧杯中,加热煮沸后,再滴入几滴植物油;
(2)选择装置甲(填“甲”或“乙”),将(1)所得溶液加入到装置中并按图示组装好装置.
(3)在你选择的装置上标明电极材料分别为a石墨、bFe
(4)实验中可在阳极附近溶液中看到稳定的白色Fe(OH)2沉淀.
(5)如果要看到白色沉淀转化为红褐色沉淀的现象,接下来的操作是将电极反向连接.
分析 (1)用煮沸的方法排出NaOH溶液中的氧气;
(2)由于铁与NaOH溶液不能发生自发的氧化还原反应,故不能设计成原电池,只能设计成电解池;
(3)在电解池中,要使铁能放电,铁应做阳极;
(4)由于铁做阳极,故Fe2+在阳极生成,则Fe(OH)2在阳极生成;
(5)要看到白色沉淀转化为红褐色沉淀的现象,只需让装置中有氧气生成即可.
解答 解:(1)由于Fe(OH)2有很强的还原性,故要想制得Fe(OH)2,必须排除装置和溶液中的氧气,而排出NaOH溶液中的氧气用煮沸的方法,故答案为:加热煮沸;
(2)原电池的反应必须是自发的氧化还原反应,而由于铁与NaOH溶液不能发生自发的氧化还原反应,故不能设计成原电池,只能设计成电解池,故答案为:甲;
(3)在电解池中,要使铁能放电变为Fe2+,铁应做阳极,即b为铁棒,阴极可以选择惰性电极,比如碳棒,即a为碳棒,故答案为:a-石墨;b-Fe;
(4)由于铁做阳极,则阳极上铁放电:Fe-2e-=Fe2+,故Fe2+在阳极生成,则Fe(OH)2在阳极生成,故答案为:阳极附近溶液中;
(5)要看到白色沉淀转化为红褐色沉淀的现象,只需让装置中有氧气生成即可,则只需让电极反向连接,则此时阳极为C棒,铁棒为阴极,则此时阳极上OH-放电生成氧气,会将Fe(OH)2氧化为Fe(OH)3,使白色沉淀转化为红褐色沉淀,故答案为:将电极反向连接.
点评 本题考查了Fe(OH)2的制取,应注意的是Fe(OH)2有很强的还原性,要防氧化,故采取加热煮沸以及加植物油等方法来防氧化.

练习册系列答案
相关题目
15.下列实验能获得成功的是( )
| A. | 向乙酸乙酯中加入足量的30%NaOH溶液,在加热的条件下观察酯层的消失 | |
| B. | 乙醇与浓硫酸混合,加热至140℃制取乙烯 | |
| C. | 向2mL的甲苯中加入3滴KMnO4酸性溶液,用力振荡,观察溶液颜色褪去 | |
| D. | 1 mol•L-1CuSO4溶液2 mL和0.5mol•L-1NaOH溶液2mL混合后加入40%的乙醛溶液0.5mL,加热煮沸观察砖红色沉淀的生成 |
16.如果你家里的食用花生油中不小心混入了水,你将采用的分离方法是( )
| A. | 过滤 | B. | 分液 | C. | 萃取 | D. | 蒸馏 |
13.下列物质露置在空气中,质量会减轻的是( )
| A. | NaOH | B. | Na2O2 | C. | 浓硫酸 | D. | 浓硝酸 |
17.要防止水体污染,改善水质,最根本的措施是( )
| A. | 控制工业废水的排放 | B. | 控制生活污水的排放 | ||
| C. | 对被污水污染了的河流进行治理 | D. | 减少用水量 |
14.下列说法中错误的是( )
| A. | SO2气体通入石蕊试液中,溶液先变红后褪色 | |
| B. | 在KI-淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应 | |
| C. | 标准状况下,22.4 L任何气体中都含有6.02×1023个分子 | |
| D. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
4.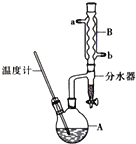 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:反应物和产物的相关数据如下
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:反应物和产物的相关数据如下
据如下:
合成正丁醚的步骤:
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石.
②加热A中反应液,迅速升温至135℃,维持反应一段时间,分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振摇后静置,分液得粗产物.
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g.
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为将浓H2SO4滴加到正丁醇中.
写出步骤②中制备正丁醚的化学方程式2CH3CH2CH2CH2OH CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.
(2)加热A前,需先从b(填“a”或“b”)口向B中通入水.
(3)步骤③的目的是初步洗去浓H2SO4,振摇后静置,粗产物应从分液漏斗的上(填“上”或“下”)口分离出.
(4)步骤④中最后一次水洗的目的为洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4.
(5)步骤⑤中,加热蒸馏时应收集d(填选项字母)左右的馏分.
a.100℃b. 117℃c. 135℃d.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为正丁醇,下层液体的主要成分为水.(填物质名称)
(7)本实验中,正丁醚的产率为33.85%.
 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:反应物和产物的相关数据如下
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:反应物和产物的相关数据如下据如下:
| 相对分 子质量 | 沸点/ ℃ | 密度 (g•cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石.
②加热A中反应液,迅速升温至135℃,维持反应一段时间,分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振摇后静置,分液得粗产物.
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g.
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为将浓H2SO4滴加到正丁醇中.
写出步骤②中制备正丁醚的化学方程式2CH3CH2CH2CH2OH
 CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O. (2)加热A前,需先从b(填“a”或“b”)口向B中通入水.
(3)步骤③的目的是初步洗去浓H2SO4,振摇后静置,粗产物应从分液漏斗的上(填“上”或“下”)口分离出.
(4)步骤④中最后一次水洗的目的为洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4.
(5)步骤⑤中,加热蒸馏时应收集d(填选项字母)左右的馏分.
a.100℃b. 117℃c. 135℃d.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为正丁醇,下层液体的主要成分为水.(填物质名称)
(7)本实验中,正丁醚的产率为33.85%.