题目内容
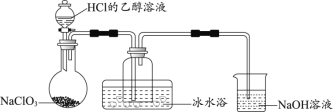
【题目】氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,实验室拟用下图所示装置制备干燥纯净的氯气,请回答下列问题。
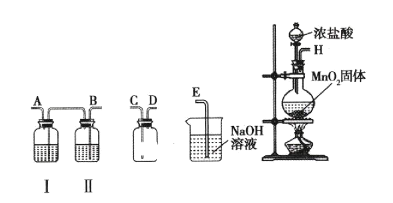
(1)I中所盛试剂为________(填序号,下同),II中所盛试剂为________。
A.氢氧化钠溶液 B.饱和食盐水 C.浓硫酸 D.硝酸银溶液
(2)请按正确的顺序连接装置:H→____、____、→____、____→____;选择最后一个装置的目的是___________________。
(3)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:____。
(4)实验室有一瓶密封不严的漂白粉样品,其中肯定含有![]() ,请设计实验探究该样品中可能存在的其他物质。
,请设计实验探究该样品中可能存在的其他物质。
I.提出合理假设。
假设1:该漂白粉未变质,含有_______________________;
假设2:该漂白粉全部变质,含有_________________________;
假设3:该漂白粉部分变质,既含有![]() ,又含有
,又含有![]() 。
。
【答案】C B B A C D E 吸收尾气,防止污染空气 ![]()
![]()
![]()
【解析】
(1)H导出的氯气中含有HCl、水蒸气,先用饱和食盐水除去HCl,再用浓硫酸干燥氯气,采取向上排空气法收集氯气,最后用氢氧化钠溶液吸收多余的氯气,防止污染空气,用氢氧化钠溶液吸收氯气防止倒吸,各装置中气体应为长进短出;I中所盛试剂为浓硫酸,答案选C;II中所盛试剂为饱和食盐水,答案选B;
(2)实验室制取氯气时,首先要制取氯气,然后通过饱和食盐水除去挥发出来的氯化氢气体,通过浓硫酸除去混入的水蒸气,这时得到了干燥、纯净的氯气,要用向上排空气法收集氯气,最后要吸收多余的氯气,注意防止倒吸,仪器连接为H→B→A→C→D→E;
(3)氯气和石灰乳反应生成氯化钙、次氯酸钙和水,反应的方程式为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(4)①漂白粉的主要成分为CaCl2和Ca(ClO)2,变质生成CaCO3,则漂白粉未变质,只含CaCl2、Ca(ClO)2,漂白粉全部变质,只含CaCl2、CaCO3,漂白粉部分变质,既含有CaCl2、Ca(ClO)2、CaCO3。

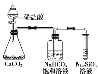
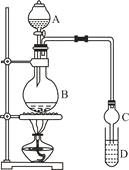
【题目】乙酸乙酯是一种用途广泛的精细化工产品。某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
已知:①氯化钙可与乙醇形成CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
③2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
I.制备过程
装置如图所示,A中放有浓硫酸,B中放有9.5mL无水乙醇和6mL冰醋酸,D中放有饱和碳酸钠溶液。
(1)写出乙酸与乙醇发生酯化反应的化学方程式 。
(2)实验过程中滴加大约3mL浓硫酸,B的容积最合适的是 (填入正确选项前的字母)
A.25mL B.50mL C.250mL D.500mL
(3)球形干燥管的主要作用是 。
(4)预先向饱和Na2CO3溶液中滴加几滴酚酞试液,目的是
。
Ⅱ.提纯方法:①将D中混合液转入分液漏斗进行分液。
②有机层用5mL饱和食盐水洗涤,再用5mL饱和氯化钙溶液洗涤,最后用水洗涤。有机层倒入一干燥的烧瓶中,用无水硫酸镁干燥,得粗产物。
③将粗产物蒸馏,收集77.1℃的馏分,得到纯净干燥的乙酸乙酯。
(5)第①步分液时,选用的两种玻璃仪器的名称分别是 、 。
(6)第②步中用饱和食盐水、饱和氯化钙溶液、最后用水洗涤,分别主要洗去粗产品中的 , , 。
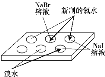
【题目】下列实验事实不能作为所得结论合理证据的是
选项 | A | B | C | D |
实验 |
|
|
|
|
现象 | NaBr溶液变为橙色,NaI溶液变为棕黄色 | Mg条表面有气泡产生 | Na2SiO3溶液中出现白色沉淀 | 钾与水反应比钠与水反应更剧烈 |
结论 | 氧化性: Cl2>Br2>I2 | 还原性: Mg>Al | 非金属性: C>Si | 金属性: K>Na |
A.AB.BC.CD.D