题目内容
【题目】乙酸乙酯是一种用途广泛的精细化工产品。某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
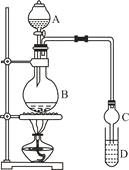
已知:①氯化钙可与乙醇形成CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
③2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
I.制备过程
装置如图所示,A中放有浓硫酸,B中放有9.5mL无水乙醇和6mL冰醋酸,D中放有饱和碳酸钠溶液。
(1)写出乙酸与乙醇发生酯化反应的化学方程式 。
(2)实验过程中滴加大约3mL浓硫酸,B的容积最合适的是 (填入正确选项前的字母)
A.25mL B.50mL C.250mL D.500mL
(3)球形干燥管的主要作用是 。
(4)预先向饱和Na2CO3溶液中滴加几滴酚酞试液,目的是
。
Ⅱ.提纯方法:①将D中混合液转入分液漏斗进行分液。
②有机层用5mL饱和食盐水洗涤,再用5mL饱和氯化钙溶液洗涤,最后用水洗涤。有机层倒入一干燥的烧瓶中,用无水硫酸镁干燥,得粗产物。
③将粗产物蒸馏,收集77.1℃的馏分,得到纯净干燥的乙酸乙酯。
(5)第①步分液时,选用的两种玻璃仪器的名称分别是 、 。
(6)第②步中用饱和食盐水、饱和氯化钙溶液、最后用水洗涤,分别主要洗去粗产品中的 , , 。
【答案】(1)CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O(2分)
(2)B (1分) (3)防倒吸 (1分)
(4)便于观察液体分层(答案合理即可得分)(1分)。
(5)分液漏斗 (1分);烧杯 (1分)
(6)碳酸钠(1分) 乙醇(1分) 氯化钙(1分)
【解析】试题I.制备过程
(1)乙酸与乙醇在浓硫酸加热的条件下发生酯化反应,生成乙酸乙酯和水,化学方程式见答案; (2)实验过程中圆底烧瓶需要加热,最大盛液量不超过其容积的一半,烧瓶内液体的总体积为18.6mL, B的容积最合适的是50mL,选B;
(3)球形干燥管的主要作用是防止倒吸;
(4)预先向饱和Na2CO3溶液中滴加几滴酚酞试液,目的是便于观察液体分层(答案合理即可得分)。
Ⅱ.提纯方法:
(5)第①步分液时,选用的两种玻璃仪器的名称分别是分液漏斗、烧杯。
(6)第②步中用饱和食盐水、饱和氯化钙溶液、最后用水洗涤,分别主要洗去粗产品中的碳酸钠、乙醇、氯化钙。