题目内容
【题目】自来水是自然界中的淡水经过絮凝、沉淀、过滤、消毒等工艺处理后得到的。常用的自来水消毒剂有二氧化氯(ClO2)和高铁酸钾(K2FeO4)等。
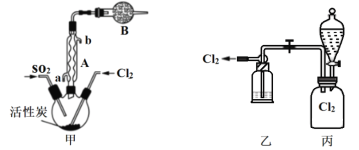
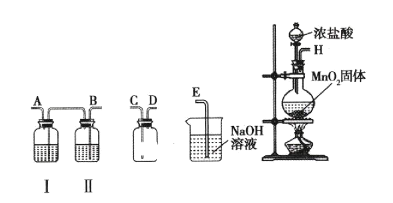
(1)某研究小组用下图装置制备少量ClO2(夹持装置已略去)。
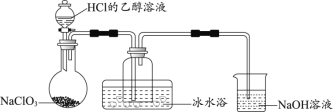
资料:ClO2常温下为易溶于水而不与水反应的气体,水溶液呈深黄绿色,11℃时液化成红棕色液体。以NaClO3和HCl的乙醇溶液为原料制备ClO2的反应为2NaClO3 + 4HCl= 2ClO2↑+ Cl2↑+ 2NaCl + 2H2O。
①冰水浴的作用是____________。
② NaOH溶液中发生的主要反应的离子方程式为________________。
(2)将ClO2水溶液滴加到KI溶液中,溶液变棕黄;再向其中加入适量CCl4,振荡、静置,观察到____,证明ClO2具有氧化性。
(3)ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO2-),需将其转化为Cl-除去。下列试剂中,可将ClO2-转化为Cl-的是_____________________(填字母序号)。
a. FeSO4 b. O3 c. KMnO4 d. SO2
(4)K2FeO4是一种新型、绿色的多功能净水剂,集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭等性能为一体。实验室制备K2FeO4的方法如下:在冰水浴中,向KClO和KOH的混合溶液中少量多次加入硝酸铁,并不断搅拌。
①上述制备K2FeO4反应的离子方程式为______________________。
②净水过程中,K2FeO4起到吸附、絮凝作用的原理是____________。
【答案】分离Cl2和ClO2 Cl2+2OH-=Cl-+ClO-+H2O 溶液分层,下层为紫色 ad 3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O 净水过程中,FeO42-发挥氧化作用,被还原成Fe3+,Fe3+水解生成Fe(OH)3胶体,起到吸附、絮凝作用
【解析】
(1)①根据反应2NaClO3 + 4HCl= 2ClO2↑+ Cl2↑+2NaCl+2H2O 可知,制备ClO2的同时生成氯气,利用ClO2 11℃时液化成红棕色液体,可用冰水浴将Cl2和ClO2分离,获得纯净的ClO2,
答案为:分离Cl2和ClO2;
② NaOH溶液为尾气处理装置,作用是吸收产生的氯气,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
答案为:Cl2+2OH-=Cl-+ClO-+H2O
(2)向混合后的溶液中加入适量CCl4,振荡、静置,CCl4密度比水大,且不溶于水,若观察到溶液分层,且下层为紫色,说明溶液中生成碘单质,进一步说明将ClO2水溶液滴加到KI溶液中发生反应,碘离子由-1价变为0价,化合价升高被氧化,则证明ClO2具有氧化性。
答案为:溶液分层,下层为紫色;
(3)需将ClO2-其转化为Cl-除去,氯元素的化合价从+3价变为-1价,化合价降低得电子,被还原,需要加入还原剂,
a. FeSO4中亚铁离子具有还原性,可以做还原剂,故a符合;
b. O3具有强氧化性,故b不符合;
c. KMnO4具有强氧化性,故c不符合;
d. SO2具有还原性,可以做还原剂,故d符合;
答案为ad;
(4)K2FeO4是一种新型、绿色的多功能净水剂,集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭等性能为一体。实验室制备K2FeO4的方法如下:在冰水浴中,向KClO和KOH的混合溶液中少量多次加入硝酸铁,并不断搅拌。
①在冰水浴中,向KClO和KOH的混合溶液中少量多次加入硝酸铁,生成高铁酸钾,Fe3+从+3价升高到+6价的FeO42-,失去3个电子,ClO-中氯元素从+1价变为-1价的氯离子,得到2个电子,最小公倍数为6,则ClO-和Cl-的系数为3,Fe3+和FeO42-系数为2,根据物料守恒,可得离子方程式为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O,
答案为:3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O;
②净水过程中,FeO42-发挥氧化作用,被还原成Fe3+,Fe3+水解生成Fe(OH)3胶体,起到吸附、絮凝作用,
答案为:净水过程中,FeO42-发挥氧化作用,被还原成Fe3+,Fe3+水解生成Fe(OH)3胶体,起到吸附、絮凝作用。

 名校课堂系列答案
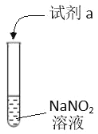
名校课堂系列答案【题目】利用下列实验探究亚硝酸钠(NaNO2)的化学性质(AgNO2是淡黄色难溶于水的固体)
实验 | 装置 | 试剂a | 现象 |
① |
| 酚酞 | 无色溶液变红 |
② | AgNO3溶液 | 产生淡黄色沉淀 | |
③ | 淀粉KI 溶液+稀硫酸 | 无色溶液立即变蓝 | |
④ | 酸性K2Cr2O7溶液 | 无色溶液变为绿色 |
由上述实验所得结论不正确的是
A.NaNO2溶液呈碱性:NO2-+H2OHNO2+OH-
B.NaNO2可与某些盐发生复分解反应:NO2-+Ag+=AgNO2↓
C.NaNO2有氧化性:2I-+2H++2NO2-=I2+2NO2↑+H2O
D.NaNO2有还原性:Cr2O72-+3NO2-+8H+=3NO3-+2Cr3++4H2O
【题目】CoCO3可用作选矿剂、催化剂及家装涂料的颜料。以含钴废渣(主要成CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
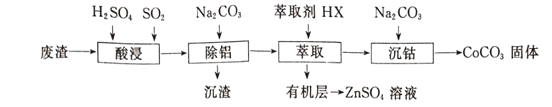
下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
(1)写出“酸溶”时发生氧化还原反应的化学方程式____________________。
(2)“除铝”过程中需要调节溶液pH的范围为_______________ 。
(3)在实验室里,萃取操作用到的玻璃仪器主要有____;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______。
(4)简述洗涤沉淀的操作____________________________________。
(5)在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴氧化物的化学式为 ____________________。