题目内容
【题目】A、B、C、D为短周期主族元素并且原子序数依次增大,其中只有A、B、C在同一周期。A元素原子核外成对电子数是未成对电子数的2倍;B元素最外层有3个未成对电子;C元素核外有3对成对电子;D元素是所在周期中原子半径最小的;E元素位于周期表的第四周期第九列。请根据相关信息,应化学用语回答下列问题:
(1)A的基态原子核中核外有___种运动状态不同的电子;B的基态原子中电子占据最高能级的电子云轮廓图为____。D的基态原子核外有____种能量不同的电子。
(2)B的氢化物BH3的VSEPR模型为____,其分子空间构型为_____;A、B、C三种元素的第一电离能由大到小的顺序为_____(填元素符号)。
(3)BO2-中B原子的杂化轨道类型为____;与AB-互为等电子体的分子有_____,离子有_____。(分别写出1种)
(4)由A、C与氢形成H2A2C4分子中,1mol该分子中含有π键的数目为____。
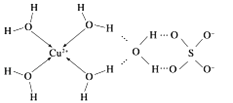
(5)E元素位于元素周期表中的___区,E3+的一种配离子[E(BH3)5D]2+中,E3+的配位数为____,配位原子为____、____。
【答案】6; 哑铃型 5 四面体型 三角锥形 N>O>C sp2 CO、N2 C22-、O22+、NO+等 2NA d 6 N Cl或Cl-
【解析】
A、B、C、D为短周期主族元素并且原子序数依次增大,其中只有A、B、C在同一周期,A元素原子核外成对电子数是未成对电子数的2倍,A是C元素;B元素最外层有3个未成对电子,B是N元素;C元素核外有3对成对电子,C是O元素;D元素是所在周期中原子半径最小的,D是Cl元素;E元素位于周期表的第四周期第九列,E是Co元素。
(1)A是C元素,C原子核外有6个电子,基态原子核中核外有6种运动状态不同的电子;B是N元素,基态N原子的核外电子排布式是1s22s22p3,电子占据最高能级是2p,电子云轮廓图为哑铃型。D是Cl元素,基态Cl原子核外电子排布式是1s22s22p63s23p5,有5种能量不同的电子。
(2)NH3中N原子价电子对数是![]() ,VSEPR模型为四面体型,有1对孤电子对,其分子空间构型为三角锥形;同周期元素从左到右,第一电离能逐渐增大,N原子2p轨道半充满,结构稳定,第一电离能大于同周期相邻元素,所以C、N、O三种元素的第一电离能由大到小的顺序为N>O>C。
,VSEPR模型为四面体型,有1对孤电子对,其分子空间构型为三角锥形;同周期元素从左到右,第一电离能逐渐增大,N原子2p轨道半充满,结构稳定,第一电离能大于同周期相邻元素,所以C、N、O三种元素的第一电离能由大到小的顺序为N>O>C。
(3)NO2-中N原子价电子对数是![]() ,所以杂化轨道类型为sp2;原子数相同、价电子数也相同的微粒互为等电子体,与CN-互为等电子体的分子有CO、N2,离子有C22-、NO+。
,所以杂化轨道类型为sp2;原子数相同、价电子数也相同的微粒互为等电子体,与CN-互为等电子体的分子有CO、N2,离子有C22-、NO+。
(4)由C、O与H形成H2C2O4分子,结构式是![]() ,1mol该分子中含有π键的数目为2NA。
,1mol该分子中含有π键的数目为2NA。
(5)Co元素价电子排布式是3d74s2,位于元素周期表中的d区,Co3+的一种配离子[Co (NH3)5Cl]2+中,E3+的配位数为6,配位原子为Cl、N。