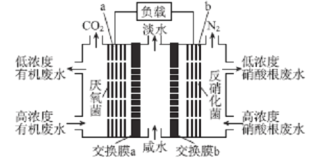
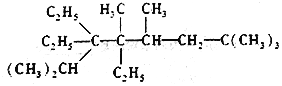
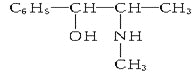
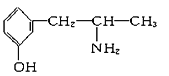
题目内容
【题目】铅丹(Pb3O4)可作防锈用涂料,已知铅丹中Pb元素的化合价只有+2、+4,且+2价稳定,+4价的Pb具有强氧化性,能氧化浓盐酸生成Cl2。则下列说法不正确的是 ( )
A. Pb3O4可表示为2PbO·PbO2
B. 可用PbO在空气中加热制备铅丹,其n(氧化剂):n(还原剂)=1:6
C. 0.1mol Pb3O4与足量的浓盐酸反应,生成Cl20.1 mol
D. a mol Pb3O4加强热分解生成PbO,则加热过程中转移电子数为2a NA
【答案】B
【解析】
A.因为铅丹中铅的化合价为+2、+4,所以根据化合价代数和为0分析,则Pb3O4中+2价铅和+4价铅的物质的量之比为2:1,所以Pb3O4可以表示为2PbO·PbO2,故正确;B.根据6PbO+O2![]() 2Pb3O4由得失电子守恒可知,氧化剂和还原剂的比例为1:2,故错误;C.根据Pb3O4可表示为2PbO·PbO2,则0.1mol Pb3O4与足量的浓盐酸反应转移0.2mol电子,由得失电子守恒则生成0.1mol氯气,故正确;D. 根据Pb3O4可表示为2PbO·PbO2,则amol Pb3O4含有amol+4价铅,其被还原为PbO要转移2amol电子,故正确。
2Pb3O4由得失电子守恒可知,氧化剂和还原剂的比例为1:2,故错误;C.根据Pb3O4可表示为2PbO·PbO2,则0.1mol Pb3O4与足量的浓盐酸反应转移0.2mol电子,由得失电子守恒则生成0.1mol氯气,故正确;D. 根据Pb3O4可表示为2PbO·PbO2,则amol Pb3O4含有amol+4价铅,其被还原为PbO要转移2amol电子,故正确。

练习册系列答案
相关题目