题目内容
2.下列说法中正确的是( )| A. | 离子化合物中可能含有共价键,共价化合物中可能含有离子键 | |
| B. | 一定条件下1 mol N2与3 mol H2在密闭容器中充分反应可生成2 mol NH3 | |
| C. | 铁质器件附有铜质配件,在接触处易生铁锈 | |
| D. | 非极性共价键只存在于双原子单质分子里 |
分析 A.含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物;
B.一定条件下,氮气和氢气的反应是可逆反应,存在化学平衡;
C.Fe、Cu和电解质溶液易构成原电池,Fe作负极易被腐蚀;
D.非极性共价键可能存在多原子分子或离子化合物中.
解答 解:A.含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,如KOH等,只含共价键的化合物是共价化合物,共价化合物一定不含离子键,故A错误;
B.一定条件下,氮气和氢气的反应是可逆反应,存在化学平衡,所以反应物不能完全转化为生成物,故B错误;
C.Fe、Cu和电解质溶液易构成原电池,Fe易失电子作负极而被腐蚀,所以Fe易生锈,故C正确;
D.非极性共价键可能存在多原子分子或离子化合物中,如CH2=CH2、Na2O2,故D错误;
故选C.
点评 本题考查较综合,涉及化合物类型判断、可逆反应、原电池原理等知识点,侧重考查化学反应基本原理及物质结构,注意概念的内涵,易错选项是D.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
12.其它条件不变,升高温度下列数据不一定增大的是( )
| A. | 可逆反应的化学平衡常数K | B. | 0.1mol/LCH3COONa溶液的PH | ||
| C. | 水的离子积常数Kw | D. | 弱电解质的电离程度 |
13.不能使品红溶液褪色的是( )
| A. | 氯气 | B. | 二氧化硫 | C. | 活性炭 | D. | 硫化氢 |
10.在相同条件下,分别将下列气体等体积混合于四支大小相同的试管中:①NO与NO2;②NO与O2;③NO2与O2;④SO2与NO2,将四支试管倒立于水中,各试管中水面上升高度应为( )
| A. | ①>②>③>④ | B. | ②>③>④>① | C. | ①=②=③=④ | D. | ③>②>①>④ |
17. A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:请回答下列问题:
A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:请回答下列问题:
(1)A在元素周期表中的位置是第3周期ⅡA族;A与E形成的化合物的电子式是 .
.
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是2Fe3++Cu═2Fe2++Cu2+.
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是C+H2O $\frac{\underline{\;高温\;}}{\;}$ CO+H2.
(4)F的盐酸盐水溶液呈酸性,原因是Al3++3H2O?Al(OH)3+3H+(用离子方程式表示);F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3.
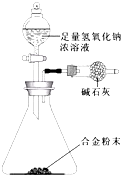
(5)A与F形成的合金是重要的工业材料.某同学仅使用天平和如图所示的装置,粗略测定某些数据即可求出该合金中A元素的含量.(装置中因空气质量引起的误差忽略不计)
①实验需要测定三个物理量:合金的质量m以及a和b.a是反应前装置和药品的总质量;b是反应后装置和药品的总质量.
②合金中A元素的质量分数是$\frac{4m-36a+36b}{m}$(用含m、a、b的式子表示).
 A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:请回答下列问题:
A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:请回答下列问题:| 元素 | 结构或性质 |
| A | 原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
| E | 与D同主族 |
| F | 与E同周期,且最外层电子数等于电子层数 |
 .
.(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是2Fe3++Cu═2Fe2++Cu2+.
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是C+H2O $\frac{\underline{\;高温\;}}{\;}$ CO+H2.
(4)F的盐酸盐水溶液呈酸性,原因是Al3++3H2O?Al(OH)3+3H+(用离子方程式表示);F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3.
(5)A与F形成的合金是重要的工业材料.某同学仅使用天平和如图所示的装置,粗略测定某些数据即可求出该合金中A元素的含量.(装置中因空气质量引起的误差忽略不计)
①实验需要测定三个物理量:合金的质量m以及a和b.a是反应前装置和药品的总质量;b是反应后装置和药品的总质量.
②合金中A元素的质量分数是$\frac{4m-36a+36b}{m}$(用含m、a、b的式子表示).
7.由乙醇制取乙二酸乙二酯时最简便的合成路线需经下列反应,①取代反应 ②加成反应 ③氧化反应 ④还原反应 ⑤消去反应 ⑥酯化反应.合成乙二酸乙二酯的正确顺序是( )
| A. | ①②③⑤⑥ | B. | ⑤②①③⑥ | C. | ⑥③①②⑤ | D. | ①②⑤③⑥ |
11.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 11.2 L氧气中所含有的原子数为NA | |
| B. | 7.8g的Na2O2中含有的阴离子的数目为0.2NA | |
| C. | 0.10mol Fe 粉与足量水蒸气反应生成的H2分子数为0.10NA | |
| D. | 54g Al分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是6NA |
 将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol•L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol•L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示: 物质的结构决定性质,性质反映其结构特点.
物质的结构决定性质,性质反映其结构特点.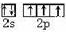 .
.