题目内容
元素推断题:
X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
X | Y |
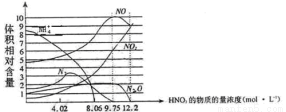
|
| Z | W |
请回答下列问题:
(1)W位于周期表中第 周期,第 族。
(2)X可形成双原子分子,其分子的电子式是 ;Y和氢元素形成的10电子微粒中常见的+1价阳离子为 (填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为 。
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式 。
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式为 。
练习册系列答案
相关题目
5.卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.

(1)卤族元素位于元素周期表的p区;溴的价电子排布式为4s24p5.
(2)测定液态氟化氢的相对分子质量,实验值大于20,原因是存在因氢键形成的缔合分子(HF)n.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(写出名称).
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图1、2所示:
请比较二者酸性强弱:HIO3>H5IO6(填“>”、“<”或“=”),原因是碘酸中非羟基氧原子数多,其正电性更高,导致I-O-H中O的电子更向I偏移,越易电离出氢离子,酸性强于高碘酸
(5)BCl3是一种非金属氯化物,其分子中B-Cl键的键角为120°,写出一种与BCl3互为等电子体的离子CO32-.
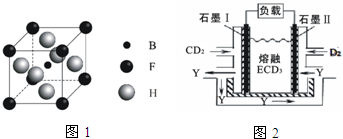
(6)如图3为碘晶体晶胞结构.有关说法中正确的是.
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(如图4)的密度为pg/cm3,NA为阿伏伽德罗常数.
①阳离子的配位数为8.
②晶胞边长a=$\root{3}{\frac{312}{ρ•{N}_{A}}}$cm(用含p、NA的代数式表示)

(1)卤族元素位于元素周期表的p区;溴的价电子排布式为4s24p5.
(2)测定液态氟化氢的相对分子质量,实验值大于20,原因是存在因氢键形成的缔合分子(HF)n.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(写出名称).
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
请比较二者酸性强弱:HIO3>H5IO6(填“>”、“<”或“=”),原因是碘酸中非羟基氧原子数多,其正电性更高,导致I-O-H中O的电子更向I偏移,越易电离出氢离子,酸性强于高碘酸
(5)BCl3是一种非金属氯化物,其分子中B-Cl键的键角为120°,写出一种与BCl3互为等电子体的离子CO32-.
(6)如图3为碘晶体晶胞结构.有关说法中正确的是.
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(如图4)的密度为pg/cm3,NA为阿伏伽德罗常数.
①阳离子的配位数为8.
②晶胞边长a=$\root{3}{\frac{312}{ρ•{N}_{A}}}$cm(用含p、NA的代数式表示)


 有A、B、C、D、E、F、G、H八种原子序数依次增大的元素(原子序数均小于30).A原子的核外电子数与电子层数相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,A、E同主族,F的基态原子s能级的电子总数与p能级的电子数相等,B、G同族,H的基态原子的3d轨道电子数是4s电子数的4倍.请回答下列问题:
有A、B、C、D、E、F、G、H八种原子序数依次增大的元素(原子序数均小于30).A原子的核外电子数与电子层数相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,A、E同主族,F的基态原子s能级的电子总数与p能级的电子数相等,B、G同族,H的基态原子的3d轨道电子数是4s电子数的4倍.请回答下列问题: