题目内容
10.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固.下列说法正确的是( )| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的化学能 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 醋酸逐渐凝固的过程要吸收能量 |
分析 A.依据反应后醋酸凝固,说明反应是吸热反应;
B.吸热反应把能量转化为产物内部能量;
C.依据反应前后能量守恒分析判断;
D.凝固是放热过程.
解答 解:A.醋酸逐渐凝固说明反应吸收热量导致醋酸溶液温度降低,即NH4HCO3与HCl的反应为吸热反应,故A错误;
B.因反应为吸热反应,即吸热的热量转化为产物内部的能量,故B正确;
C.因反应为吸热反应,则反应后生成物的总能量高于反应物的总能量,故C错误;
D.凝固是放热过程,熔化是吸热过程,故D错误;
故选B.
点评 本题考查化学反应能量变化判断,热化学方程式书写方法,能量守恒的应用分析是解题关键,题目难度中等.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
20.下列物质中,不能发生消去反应的是( )
①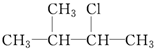 ②CH2Br2 ③
②CH2Br2 ③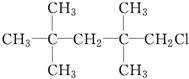 ④CH2═CHBr.
④CH2═CHBr.
①
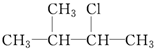 ②CH2Br2 ③
②CH2Br2 ③ ④CH2═CHBr.
④CH2═CHBr.| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
1.下列关于乙酸的叙述中不正确的是( )
| A. | 普通的食醋中含3%~5%(质量分数)的乙酸 | |
| B. | 醋酸是一种弱酸,其酸性比碳酸更弱 | |
| C. | 可以用醋除去烧开水的壶内壁的水垢 | |
| D. | 在一定条件下,乙酸能与乙醇发生酯化反应 |
5.对表中有关离子方程式书写评价合理的是( )
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | Fe3O4与过量稀硝酸反应:Fe3O4+8H+→2Fe3++Fe2++4H2O | 正确 |
| B | 在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液: 2Fe3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Fe(OH)3↓ | 正确 |
| C | 在稀氨水中通入过量CO2:NH3•H2O+CO2→NH4++HCO3- | 正确 |
| D | FeBr2溶液与等物质的量的Cl2反应: 2Fe2++2Br-+2Cl2→2Fe3++4Cl-+Br2 | 错误,Fe2+与Br-的化学计量数之比应为1:2 |
| A. | A | B. | B | C. | C | D. | D |
15.如表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(3)小题用元素符号或化学式回答,(4)~(6)小题按题目要求回答.
(1)最高价氧化物的水化物碱性最强的物质是Mg(OH)2,呈两性的物质是Al(OH)3.
(2)A分别与D、E、F、G、H形成的化合物中,最稳定的物质是HF
(3)在B、C、E、F、G、H中,原子半径最大的是Mg
(4)A和E组成的最简单化合物的结构式
(5)用电子式表示B和H组成化合物的形成过程
(6)H的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式6H++Al2O3=2Al3++3H2O.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)A分别与D、E、F、G、H形成的化合物中,最稳定的物质是HF
(3)在B、C、E、F、G、H中,原子半径最大的是Mg
(4)A和E组成的最简单化合物的结构式

(5)用电子式表示B和H组成化合物的形成过程

(6)H的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式6H++Al2O3=2Al3++3H2O.
2.Fenton试剂常用于氧化降解有机污染物X.在一定条件下,反应初始时c(X)=2.0×10-3 mol•L-1,反应10min进行测定,得图1和图2.下列说法不正确的是( )
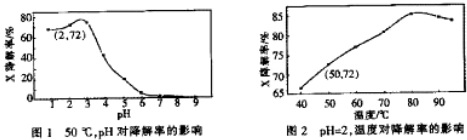

| A. | 温度为50℃,pH在3~6之间,X降解率随pH增大而减小 | |
| B. | pH=2,温度在40~80℃,X降解率温度升高而增大 | |
| C. | 无需再进行后续实验,就可以判断最佳反应条件是:pH=3、温度为80℃ | |
| D. | pH=2,温度为50℃,10min内v(X)=1.44×10-4 mol•L-1 min-1 |
19.某稀溶液中含有4mol KNO3和2.5molH2SO4,向其中加入1.5mol Fe,充分反应(已知NO3-被还原为NO).下列说法正确的是( )
| A. | 反应后生成NO的体积为28 L | B. | 所得溶液中的溶质只有FeSO4 | ||
| C. | 所得溶液中c(NO3-)=2.75 mol.L-1 | D. | 所得溶液中c(Fe2+):c(Fe3+ )=1:1 |