题目内容
【题目】将一定质量的Na2CO3和NaHCO3的固体混合物充分加热至恒重,共收集到CO2为2.24L。充分冷却后,向残留的固体中逐滴加入稀盐酸至没有气体放出为止,恰好用去稀盐酸100mL,又收集到CO2为4.48L(假设气体的体积均在标准状况下测定;反应后溶液的体积仍为100mL)。试计算:
⑴原固体混合物中Na2CO3与NaHCO3的物质的量之比为_____________________
⑵反应后的溶液中溶质的物质的量浓度为______________________________
【答案】 1:2 4.00 mol/L
【解析】⑴.将一定质量的Na2CO3和NaHCO3的固体混合物充分加热至恒重,只有NaHCO3发生分解反应,方程式为:2NaHCO3![]() Na2CO3+CO2↑+H2O,此时收集到标准状况下CO22.24L,则CO2为2.24L÷22.4L/mol=0.1mol,根据方程式可知原固体混合物中含有0.2mol的NaHCO3,同时得到0.1mol的Na2CO3;
Na2CO3+CO2↑+H2O,此时收集到标准状况下CO22.24L,则CO2为2.24L÷22.4L/mol=0.1mol,根据方程式可知原固体混合物中含有0.2mol的NaHCO3,同时得到0.1mol的Na2CO3;
因残留的固体中只有Na2CO3,则加入盐酸后的反应方程式是:Na2CO3+2HCl=2NaCl+CO2↑+H2O,向残留的固体中逐滴加入稀盐酸至没有气体放出为止,又收集到标准状况下CO24.48L,即CO2为4.48L÷22.4L/mol=0.2mol,根据反应方程式可知Na2CO3的物质的量是0.2mol,同时生成NaCl0.4mol,因NaHCO3分解生成的Na2CO3是0.1mol,则原固体混合物中的Na2CO3是0.2mol-0.1mol=0.1mol,所以原固体混合物中Na2CO3与NaHCO3的物质的量之比为0.1mol:0.2mol=1:2,故答案是:1:2;
⑵.因残留固体与稀盐酸恰好完全反应,则反应后的溶液中只有NaCl,根据上述分析可知,NaCl的物质的量是0.4mol,则c(NaCl)=0.4mol÷0.1L=4.00mol/L,故答案是:4.00mol/L。

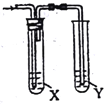
【题目】欲用下图装置对所制备的气体进行除杂检验,其设计方案合理的是
制备气体 | X(除杂试剂) | Y(检验试剂) |
| |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 | |
B | 电石与NaCl水溶液 | H2O | Br2的水溶液 | |
C | C2H5OH与浓硫酸加热至170℃ | 饱和NaHSO3溶液 | K2Cr2O7酸性溶液 | |
D | 生石灰与浓氨水 | 浓硫酸 | 红色石蕊试纸 |
A. A B. B C. C D. D
【题目】下列是部分短周期中第二、第三周期元素的原子半径及主要化合价.
元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
主要化合价 | +1 | +2 | +1 | +3 | +5、﹣3 | +7、﹣1 | +5、﹣3 | ﹣2 |
回答下列问题:
(1)⑧在元素周期表中的位置是(周期、族);
(2)8个元素的最高价氧化物的水化物中,酸性最强的是(填化学式);
(3)元素⑤、⑦、⑧分别形成的简单气态氢化物中,⑦的电子式为 , 稳定性最强的氢化物的结构式为;
(4)写出①、④的最高价氧化物对应的水化物之间发生反应的离子方程式;
(5)用电子式表示元素①与⑥形成化合物的过程 .