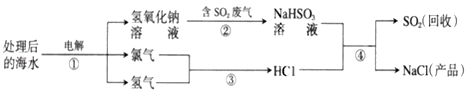
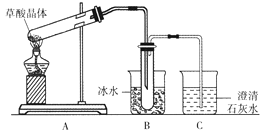
题目内容
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( ) 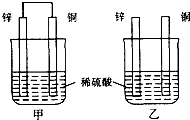
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均减小
D.产生气泡的速度甲比乙快
【答案】D
【解析】解:A.甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2 , 所以甲中铜片表面有气泡产生,故A错误;
B.乙中不构成原电池,铜片不是电极,故B错误;
C.甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,溶液的pH值都增大,故C错误;
D.甲能形成原电池,乙不能构成原电池,所以产生气泡的速度甲比乙快,故D正确;
故选D.
甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2 , 总反应式为:Zn+H2SO4=ZnSO4+H2↑.乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,以此进行分析.

练习册系列答案
相关题目